题目内容
【题目】为了测定某品牌食用纯碱中碳酸钠的质量分数,小明取10克食用纯碱样品和足量的溶质质量分数为10%的稀硫酸,进行如图甲实验,实验前后,均需往装置中缓慢通一会儿氮气.(样品中其他成分不与稀硫酸反应,氮气不参与任何反应)
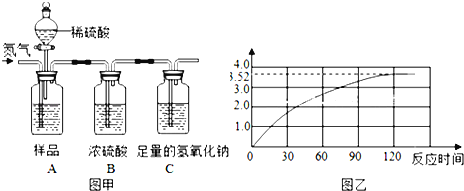
(1)实验前,先往A装置通入一会儿氮气的目的是 .
A、避免容器中的空气对实验干扰
B、检验装置的气密性
C、将反应产生的CO2气体全部赶到C装置中
(2)纯碱样品与稀硫酸充分反应后,产生的CO2气体的质量是 克.
(3)随着纯碱样品与稀硫酸反应,C装置增加的质量变化情况如图乙所示,则该食用纯碱中碳酸钠的质量分数是多少?(Na2CO3+H2SO4═Na2SO4+H2O+CO2↑)
(4)若将稀硫酸换为浓盐酸,实验中C装置增加的质量会偏大,请说明理由 .
【答案】(1)A;
(2)3.52;
(3)84.8%;
(4)浓盐酸中挥发出的氯化氢气体被氢氧化钠溶液吸收了.
【解析】
试题分析:(1)根据实验前,先往A装置通入一会氮气的目的是避免装置内原有的二氧化碳对实验的干扰进行分析;
(2)根据图象中的数据和转折点进行分析;
(3)根据二氧化碳的质量,结合碳酸钠与稀硫酸反应的化学方程式,即可解答;
(4)根据浓盐酸具有挥发性,挥发出的气体被C装置中的氢氧化钠溶液吸收,造成实验中C装置增加的质量会偏大进行分析.
(1)实验前,先往A装置通入一会氮气的目的是排净瓶内空气避免装置内原有的二氧化碳对实验的干扰;
(2)由图可知生成二氧化碳质量为3.52g;
(3)设纯碱样品中含碳酸钠的质量为x,
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106 44
x 3.52g
![]() =
=![]()
x=8.48g
该食用纯碱中碳酸钠的质量分数是:![]() ×100%=84.8%;
×100%=84.8%;
(4)浓盐酸具有挥发性,挥发出的气体被C装置中的氢氧化钠溶液吸收,造成实验中C装置增加的质量会偏大.





