题目内容
【题目】在实验室加热32.5g二氧化锰和氯酸钾的固体混合物制取氧气时,剩余固体物质的质量变化如图所示.请计算: 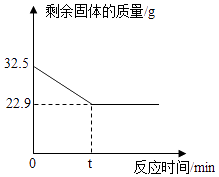
(1)完全反应时,生成氧气的质量为克.
(2)完全反应后,剩余固体物质是(填化学式).
(3)完全反应后,把剩余固体倒入l00g蒸馏水中,充分溶解,求所得溶液中溶质的质量分数(最后结果保留0.1%).
【答案】
(1)9.6
(2)KCl和MnO2
(3)解:设生成9.6g的氧气的同时生成的氯化钾的质量为x
2KClO3 | 2KCl+ | 3O2↑ |
149 | 96 | |
x | 9.6g |
![]() =
= ![]()
x=14.9g
充分溶解,求所得溶液中溶质的质量分数为 ![]() ×100%≈13.0%
×100%≈13.0%
答:完全反应后,把剩余固体倒入l00g蒸馏水中,充分溶解,求所得溶液中溶质的质量分数约为13.0%
【解析】解:由质量守恒定律可得,生成的氧气的质量为32.5g﹣22.9g=9.6g
由于是完全反应,所以剩余固体为生成的氯化钾和作催化剂的二氧化锰,对应的化学式为:KCl和MnO2(填化学式).
设生成9.6g的氧气的同时生成的氯化钾的质量为x
2KClO3 | 2KCl+ | 3O2↑ |
149 | 96 | |
x | 9.6g |
![]() =
= ![]()
x=14.9g
充分溶解,求所得溶液中溶质的质量分数为 ![]() ×100%≈13.0%
×100%≈13.0%
答:(1)完全反应时,生成氧气的质量为 9.6克.(2)完全反应后,剩余固体物质是 KCl和MnO2.(3)完全反应后,把剩余固体倒入100g蒸馏水中,充分溶解,求所得溶液中溶质的质量分数约为13.0%.
【考点精析】根据题目的已知条件,利用根据化学反应方程式的计算的相关知识可以得到问题的答案,需要掌握各物质间质量比=系数×相对分子质量之比.

【题目】正确设计实验方案是顺利完成实验探究的重要保障,下列实验方案设计,能达到实验目的是( )
选项 | 实验目的 | 实验方案 |
A | 除去天然水中的不溶性杂质 | 过滤 |
B | 鉴别二氧化碳和氮气 | 将燃着的木条分别伸入气体中 |
C | 除去二氧化碳中混有的一氧化碳 | 混入氧气,点燃 |
D | 鉴别木炭粉末和氧化铜粉末 | 观察颜色 |
A.AB.BC.CD.D