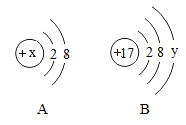
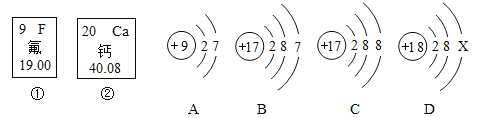
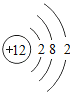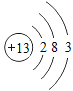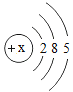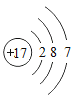题目内容
【题目】电动自行车、小汽车等交通工具中都有为其提供电能的铅蓄电池(又称“电瓶”),它的优点是可以充电循环使用。电瓶的正极材料是二氧化铅(PbO2), 负极材料是金属铅(Pb),电瓶内所加液体是溶质质量分数为36%的稀硫酸,放电(为外界供电)时发生反应的化学方程式如下:![]() 。当放电时,反应物反应掉一定量后,就会导致电压下降,不能正常使用,这时就必须及时充电。
。当放电时,反应物反应掉一定量后,就会导致电压下降,不能正常使用,这时就必须及时充电。
(1) PbO2中铅元素与氧元素的质量比为_____。
(2)若用86.4%的浓硫酸来配制该稀硫酸1200克,需要加水多少克?_____
(3)假如某个电瓶中内装36%的稀硫酸1200克,当有414克的铅恰好反应完时,求反应后溶液中硫酸的质量分数_____(最后结果保留一位小数)。
【答案】207:32 700克 4.5%
【解析】
(1) PbO2中铅元素与氧元素的质量比为![]() 。
。
(2)由题意电瓶内所加液体是溶质质量分数为36%的稀硫酸,若用86.4%的浓硫酸来配制该稀硫酸1200克,设需要浓硫酸的质量为x,则有:
![]() ,解得x=500克
,解得x=500克
需要加水的质量为1200克-500克=700克
答:需要加水700克。
(3)由题意某个电瓶中内装36%的稀硫酸1200克,当有414克的铅恰好反应完时,设参加反应的硫酸的质量为y,生成的水的质量为z,则有:

由![]() ,解得y=392g
,解得y=392g
由![]() ,解得z=72g
,解得z=72g
反应后溶液中剩余硫酸的质量为![]()
反应后溶液的质量为1200克-392克+72克=880克
反应后溶液中硫酸的质量分数为![]()
答:反应后溶液中硫酸的质量分数为4.5%。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
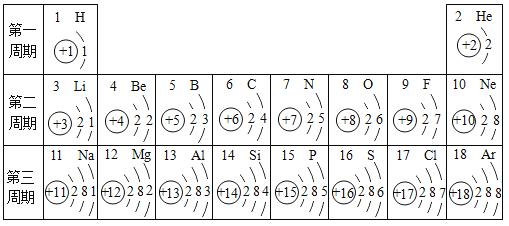
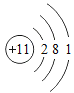
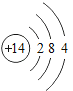
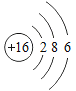
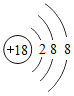
小学生10分钟应用题系列答案【题目】下表为元素周期表中某一周期元素的原子结构示意图。请回答下列问题:
元素名称 | 钠 | 镁 | 铝 | 硅 | 磷 | 硫 | 氯 | 氩 |
元素符号 | Na | Mg | Al | Si | P | S | Cl | Ar |
原子结构示意图 |
|
|
|
|
|
|
|
|
(1)氯离子的结构示意图为_____。
(2)下列说法正确的是_____(填序号)。
A 具有相对稳定结构的原子是氩
B 钠元素与氯元素形成的化合物是由分子直接构成的物质
C 镁离子失去电子形成原子
D 质子数决定元素种类,故质子数相等的微粒,一定是同种元素
(3)上表微粒中,与碳有相似化学性质的元素是_____。
(4)硫和地壳中含量最高的金属元素形成的化合物的化学式是_____。