题目内容
【题目】通过海水“晾晒”可得粗盐,粗盐中除了NaCl 外,还含有MgCl2 、CaCl2、Na2SO4以及泥沙等杂质。为了得到纯净的氯化钠,进行了如下实验操作:
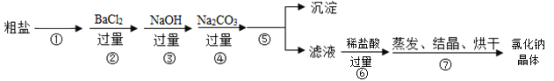
(1)整个实验过程中能产生新的NaCI的复分解反应共有_____个。
(2)写出步骤②中反应的化学方程式______。
(3)步骤⑥中加入过量稀盐酸对最终得到的氯化钠晶体的纯度是否有影响__?并说明原因______。
【答案】6 ![]() 没有影响 因为盐酸具有挥发性,在蒸发结晶过程中过量的氯化氢会被除去,不会影响最终得到氯化钠的纯度。
没有影响 因为盐酸具有挥发性,在蒸发结晶过程中过量的氯化氢会被除去,不会影响最终得到氯化钠的纯度。
【解析】
③⑤③
(1)整个实验过程中能产生新的NaCl的反应:步骤②中氯化钡和硫酸钠反应生成硫酸钡沉淀和氯化钠,为复分解反应;步骤③中氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,为复分解反应;步骤④中碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,碳酸钠和氯化钡反应生成碳酸钡沉淀和氯化钠,均为复分解反应;步骤⑥盐酸和氢氧化钠反应生成氯化钠,盐酸和碳酸钠反应生成氯化钠、水和二氧化碳,均为复分解反应,故整个实验过程中能产生新的NaCI的复分解反应共有6个。
(2)步骤②中反应:氯化钡和硫酸钠反应生成硫酸钡沉淀和氯化钠,化学方程式![]() 。
。
(3)步骤⑥中加入过量稀盐酸对最终得到的氯化钠晶体的纯度没有影响,因为盐酸具有挥发性,在蒸发结晶过程中过量的氯化氢会被除去,不会影响最终得到氯化钠的纯度。

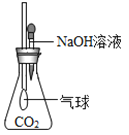
【题目】实验室常用下列装置来制取氧气:

(1)写出图中有标号仪器的名称:a_____;b_____;
(2)B、C装置均可用来制取氧气。若用B装置来制取氧气,长颈漏斗添加药品的名称_____;与B装置比较,C装置的优点是_____,若用A装置在试管口放一团棉花,利用加热一种暗紫色固体制取氧气,其化学方程式为_____;
(3)可以用D装置收集氧气的原因是_____,
(4)若用如图G装置收集较纯净氧气,可先在G装置中装满水,气体从_____进入(填“c”或“d”);
(5)实验室常用氯化铵固体与碱石灰固体共热来制取氨气。常温下氨气是一种无色有刺激性气味的气体,密度比空气小,极易溶于水。若制取并收集氨气,应该从上图A-E中选择的发生装置和收集装置分别是_____、_____,
(6)以下是某研究小组探究影响反应速率部分因素的相关实验数据。
实验序号 | 过氧化氢溶液浓度%溶 | 过氧化氢溶液体积/mL | 温度/℃ | 二氧化锰的用量/g | 收集氧气的体积/mL | 反应所需的时间/s |
① | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
② | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
③ | 30 | 5 | 35 | 2 | 49.21 | |
④ | 30 | 5 | 55 | 2 | 10.76 |
a.通过实验③和④对比可知,化学反应速率与温度的关系是_____;
b.若用一定量15%的过氧化氢溶液制氧气,为了减小反应速率,可加适量的水稀释,则产生氧气的总重量将_____选填“减小、不变或增大”)。