题目内容
【题目】(7分)氧化镁在医药、建筑等行业应用广泛.硫酸镁还原热解制备高纯氧化镁是一种新的探索.以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
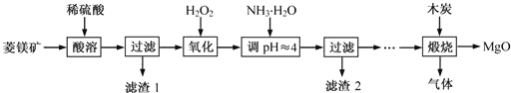
(1)MgCO3与稀硫酸反应的化学方程式为 ;
(2)加入H2O2 氧化时,发生反应的化学方程式为(已经配平,X属于常见的化合物):
![]() ,则X的化学式为 ;
,则X的化学式为 ;
(3)NH3·H2O是氨水的主要成分,溶液显 性,加入氨水时,溶液的PH值 (填“增大”、“减少”或“不变”),当PH≈4时,会产生红褐色沉淀,则滤渣2 的成分是 (填化学式)。
(4)通常用PH试纸测定溶液的PH值,其操作方法是 。
(5)煅烧过程存在以下反应:木炭和硫酸镁在高温下除得到氧化镁外,还得两种气体,一种会造成酸雨,另一种大量排放则会引起温室效应。请写出该反应的化学方程式: 。
【答案】(1)MgCO3+H2SO4═MgSO4+CO2↑+H2O .(2)H2SO4;(3)碱性,增大,Fe(OH)3
(4)取出一片干燥的pH试纸,放在玻璃片(或表面皿)上,用玻璃棒蘸取溶液,然后涂抹在pH试纸上,待试纸变色完全后,和标准比色卡对照。
(5)2MgSO4+C![]() 2MgO+CO2↑+2SO2↑
2MgO+CO2↑+2SO2↑
【解析】
试题分析:(1)根据碳酸盐的性质可知碳酸镁与硫酸反应生成硫酸镁、二氧化碳、水,反应的化学方程式为:MgCO3+H2SO4═MgSO4+CO2↑+H2O .(2)根据质量守恒定律可知,X的化学式为H2SO4;(3)NH3·H2O是氨水的主要成分,溶液显碱性,加入氨水时,溶液的PH值增大,当pH≈4时,会产生红褐色沉淀,则滤渣2 的成分是氢氧化铁化学式为Fe(OH)3(4)通常用pH试纸测定溶液的pH值,其操作方法是取出一片干燥的pH试纸,放在玻璃片(或表面皿)上,用玻璃棒蘸取溶液,然后涂抹在pH试纸上,待试纸变色完全后,和标准比色卡对照。(5)根据题中的叙述,反应的化学方程式为2MgSO4+C![]() 2MgO+CO2↑+2SO2↑。
2MgO+CO2↑+2SO2↑。

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案【题目】下列关于水的叙述,错误的是
A、电解水时,与电源正极相连的玻璃管内得到的气体能在空气中燃烧
B、冰是由氢元素和氧元素组成的
C、生活中通过煮沸可降低水的硬度
D、净化水的方法有吸附、沉淀、过滤和蒸馏等
【题目】(5分)粗盐中含泥沙、氯化钙、氯化镁等杂质,某同学自制的简易净水器(如图1)中放置物质的顺序错误,使净水效果不理想。
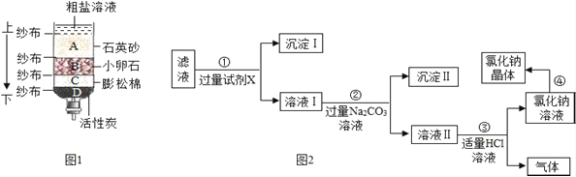
(1)请按由上到下的顺序重新排列 (填字母).调整后净化的盐水仍含可溶性杂质,他设计了下面的除杂流程:
(2)如图2中步骤①②都需要进行 操作,步骤④需要进行 操作;
(3)已知试剂X是碱溶液,则沉淀Ⅰ为 (写化学式),下列碱溶液不符合要求的是_________(填序号)。
A.氢氧化钠溶液 | B.氢氧化钡溶液 | C.氢氧化钾溶液 | D.氢氧化钙溶液 |
(4)步骤②除去氯化钙的反应方程式是 ;步骤③中发生中和反应的化学方程式是 。