题目内容
【题目】氯化钠是一种重要的化工原料,利用海水可制得氯化钠并进而可以制造氢氧化钠、氢气和氯气(Cl2)。其主要工艺流程如下图所示。
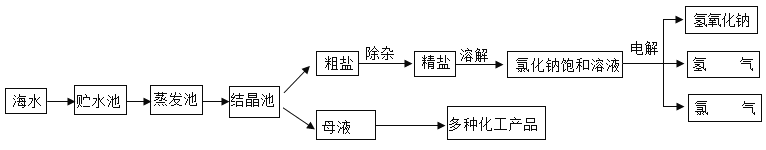
(1)氯原子的结构示意图为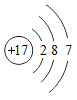 ,其核电荷数为
,其核电荷数为
(2)海水在贮水池里待澄清的净水方法是______。
(3)粗盐中含有多种可溶性杂质(氯化镁、氯化钙等)和不溶性杂质(泥沙等)。
①实验室进行粗盐中难溶性杂质的去除,多步操作需要用到的同一种玻璃仪器是_____。
②实验室要除去粗盐中的氯化钙,可加入适量的_____(填序号)。
A K2CO3溶液
B AgNO3溶液
C Na2CO3溶液
(4)常温下,配制1000kg质量分数为26.5%的氯化钠饱和溶液,需要氯化钠的质量为____Kg。
(5)电解氯化钠饱和溶液的化学方程式是_____。
【答案】17 得到 静置沉淀 玻璃棒 C 265 ![]()
【解析】
(1)由氯原子的结构示意图为 可知,圆圈内的数字为17,其核电荷数为17,最外层电子数是7,大于4,在化学反应中该原子易得到电子。
可知,圆圈内的数字为17,其核电荷数为17,最外层电子数是7,大于4,在化学反应中该原子易得到电子。
(2)海水在贮水池里待澄清的净水方法是:静置沉淀。
(3)①实验室进行粗盐中难溶性杂质的去除,多步操作需要用到的同一种玻璃仪器是玻璃棒,溶解(玻璃棒其搅拌,加速溶解的作用);过滤(玻璃棒起到引流的作用);蒸发(玻璃棒起到搅拌,防止局部温度过高,造成液滴飞溅的作用)。
②实验室要除去粗盐中的氯化钙,由于氯化钙能与碳酸钠反应生成了碳酸钙沉淀和氯化钠,不引入新的杂质,所以可加入适量的Na2CO3溶液溶液;
故填:C。
(4)需要氯化钠的质量为:1000kg×26.5%=265kg。
(5)由流程可知,电解氯化钠饱和溶液生成了氢氧化钠、氢气和氯气,根据质量守恒定律,化学反应前后,元素的种类不变,反应物中含Na、Cl,生成物中含Na、O、H、Cl,故水参与了反应,反应化学方程式是:![]() 。
。

【题目】某品牌加酶洗衣粉使用方法中提示:用温水浸泡。某科学兴趣小组对该加酶洗衣粉洗涤效果与水温之间的关系进行研究,每次实验所选的衣料、奶渍的量、洗衣粉的用量和用水量均相同。在不同水温条件下,测得这种加酶洗衣粉除去衣服上奶渍所需的时间,实验结果如下表所示:
水温(℃) | 30 | 40 | 50 | 60 | 70 | 80 |
除去奶渍所需的时间(秒) | 28 | 12 | 6 | 4 | 12 | 17 |
根据表中有关数据判断,能正确表示温度对该酶催化效率影响的图象是( )
A. 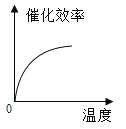 B.
B. 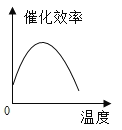 C.
C. 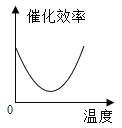 D.
D. 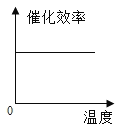
【题目】分类、类比和总结是初中常用的学习方法。
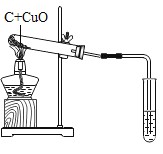
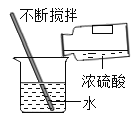
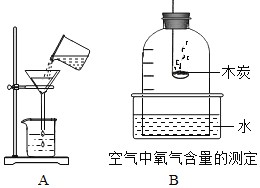
(1)化学反应在生成新物质的同时,还伴随着能量的变化;能量的变化通常表现为热量的变化,有些反应是放出热量的,有些反应则是吸收热量的。请以此为依据将下列实验进行分类。可将________(填字母)分为一类,分类的依据为_____。
|
|
|
|
A、锌与盐酸反应 | B、木炭还原氧化铜 | C、浓硫酸稀释 | D、醋的酿造 |
(2)氯气、氧气、硫单质是常见的氧化剂,判断氧化剂氧化性的方法可以根据产物的价态高低判断,规律是:当变价的物质在相似的条件下作用于不同的氧化剂时,可根据产物价态的高低进行判断,一般产物的价态越高,对应氧化剂的氧化性越强;产物的价态越低,对应氧化剂的氧化性越弱。铁在硫单质与氯气中反应的化学方程式分别为 Fe+S![]() FeS、2Fe+3Cl2
FeS、2Fe+3Cl2 ![]() 2FeCl3 ,由此可以判断氯气、氧气、硫单质三种物质的氧化性由强到弱的顺序为 __________。
2FeCl3 ,由此可以判断氯气、氧气、硫单质三种物质的氧化性由强到弱的顺序为 __________。
【题目】小明同学发现上个月做实验用的氢氧化钠溶液忘记了盖瓶盖,对于该溶液是否变质,小明邀约几个喜欢探究的同学对此进行了探究。请你一起完成下列实验报告。
(1)(提出问题1)该溶液是否变质?
(实验探究1)
实验步骤 | 实验现象 | 解释与结论 |
取少量该溶液放于试管中,滴加足量稀盐酸 | 有____产生 | 说明该溶液已变质,变质的原因是____(请用化学方程式表示) |
(2)(提出问题2)该溶液变质程度怎样?
(提出猜想)
猜想一:已完全变质,该溶液中溶质只含Na2CO3
猜想二:部分变质,该溶液中溶质含有____。
(查阅资料)氯化钡溶液呈中性。
(实验探究2)
实验步骤 | 实验现象 | 结论 |
先取少量该溶液放于试管中,加入过量氯化钡溶液 | 有____生成 | 猜想____成立 |
静置,取上层清液于另一支试管中,加入2-3滴酚酞溶液 | 上层清液变红 |
(3)(反思交流)在(实验探究2)中加入过量的氯化钡溶液的目的是什么?____