题目内容
22、高铁酸钾(K2Fe04)是具有紫色光泽的微细结晶粉末,它的氧化性超过高锰酸钾,是一种集氧化、吸附、凝聚、杀菌、灭藻的新型、高效的多功能水处理剂.干燥的高铁酸钾在198℃以下是稳定的,受热易分解为氧化铁、金属氧化物和氧气.根据上述信息,请回答下列问题:
(1)高铁酸钾的物理性质是
(2)高铁酸钾中铁元素的化合价为
(3)保存高铁酸钾时应注意
(4)试完成高铁酸钾与水反应的化学方程式.4K2FeO4+10H2O=4Fe(OH)3↓+8KOH+
(1)高铁酸钾的物理性质是
紫色粉末
(2)高铁酸钾中铁元素的化合价为
+6
;(3)保存高铁酸钾时应注意
防潮避热
;(4)试完成高铁酸钾与水反应的化学方程式.4K2FeO4+10H2O=4Fe(OH)3↓+8KOH+
3
O2
.分析:(1)紫色粉末属于高铁酸钾的物理性质;
(2)根据在化合物中正负化合价代数和为零,进行解答本题;
(3)高铁酸钾受热时容易分解,保存时要注意防潮避热;
(4)根据反应物和生成物及其质量守恒定律可以正确的书写化学方程式.
(2)根据在化合物中正负化合价代数和为零,进行解答本题;
(3)高铁酸钾受热时容易分解,保存时要注意防潮避热;
(4)根据反应物和生成物及其质量守恒定律可以正确的书写化学方程式.
解答:解:(1)颜色、状态属于高铁酸钾的物理性质,故填:紫色粉末;
(2)根据在化合物中正负化合价代数和为零,可得高铁酸钾中铁元素的化合价为:(+1)×2+x+(-2)×4=0,
则x=+6;
(3)因为高铁酸钾在水中或受热的情况下不稳定,容易发生化学反应,所以保存高铁酸钾时应注意防潮避热;
(4)高铁酸钾与水反应,利用质量守恒定律中关于各元素原子数在反应前后不变的知识对产物中的物质进行确定即可,反应前有4×2﹦8个K,反应后也有8×1﹦8个K,反应前有4×1﹦4个Fe,反应后也有4×1﹦4Fe个,反应前有10×2﹦20个H,反应后也有4×3+8×1﹦20个H,反应前有4×4+10×1﹦26个O,反应后有4×3+8×1﹦20个O,缺6个O,故为3O2,其化学方程式为:4K2FeO4+10H2O=4Fe(OH)3↓+8KOH+3O2.
故答案为:
(1)紫色粉末;
(2)+6;
(3)防潮避热;
(4)4K2FeO4+10H2O=4Fe(OH)3↓+8KOH+3O2.
(2)根据在化合物中正负化合价代数和为零,可得高铁酸钾中铁元素的化合价为:(+1)×2+x+(-2)×4=0,
则x=+6;
(3)因为高铁酸钾在水中或受热的情况下不稳定,容易发生化学反应,所以保存高铁酸钾时应注意防潮避热;
(4)高铁酸钾与水反应,利用质量守恒定律中关于各元素原子数在反应前后不变的知识对产物中的物质进行确定即可,反应前有4×2﹦8个K,反应后也有8×1﹦8个K,反应前有4×1﹦4个Fe,反应后也有4×1﹦4Fe个,反应前有10×2﹦20个H,反应后也有4×3+8×1﹦20个H,反应前有4×4+10×1﹦26个O,反应后有4×3+8×1﹦20个O,缺6个O,故为3O2,其化学方程式为:4K2FeO4+10H2O=4Fe(OH)3↓+8KOH+3O2.
故答案为:
(1)紫色粉末;
(2)+6;
(3)防潮避热;
(4)4K2FeO4+10H2O=4Fe(OH)3↓+8KOH+3O2.
点评:解答本题要掌握化学方程式的书写方法,能够正确的区分物质的物理性质和化学性质,以及考查根据在化合物中正负化合价代数和为零计算指定元素化合价的解题能力及分析题中信息进行解题的能力,只有这样才能对问题做出正确的判断.

练习册系列答案
相关题目
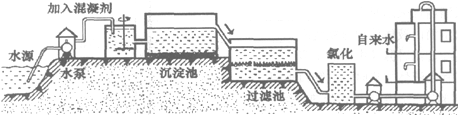
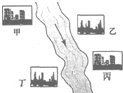 HCl中的一种.某环保小组对河水监测时发现:甲处河水呈无色;乙处河水呈红褐色;丙处河水由浑变清;丁处产生气泡,河水澄清.请回答:
HCl中的一种.某环保小组对河水监测时发现:甲处河水呈无色;乙处河水呈红褐色;丙处河水由浑变清;丁处产生气泡,河水澄清.请回答: