题目内容
18、高铁酸钾(K2Fe04)是具有紫色光泽的粉末,它是一种集氧化、吸附、凝聚、杀菌、灭藻的新型、高效的多功能水处理剂.干燥的高铁酸钾在198℃以下是稳定的,受热易分解、变质.根据上述信息,请回答下列问题:
(1)高铁酸钾的物理性质是
(2)高铁酸钾中铁元素的化合价为
(3)为防止高铁酸钾变质,保存时应注意
(1)高铁酸钾的物理性质是
具有紫色光泽的粉末
;(2)高铁酸钾中铁元素的化合价为
+6
;(3)为防止高铁酸钾变质,保存时应注意
应该在阴凉干燥处密封保存
;分析:可以根据高铁酸钾的性质和化合价等方面的知识进行分析、考虑,从而得出正确的结论.
解答:解:(1)颜色、状态属于物质的物理性质.故填:具有紫色光泽的粉末.
(2)高铁酸钾中钾元素的化合价是+1价,氧元素的化合价是-2价,根据化合物中元素化合价代数和为零的原则可以求出铁元素的化合价为+6价.故填:+6.
(3)因为高铁酸钾受热易分解、变质,所以应该在阴凉干燥处密封保存.故填:应该在阴凉干燥处密封保存.
(2)高铁酸钾中钾元素的化合价是+1价,氧元素的化合价是-2价,根据化合物中元素化合价代数和为零的原则可以求出铁元素的化合价为+6价.故填:+6.
(3)因为高铁酸钾受热易分解、变质,所以应该在阴凉干燥处密封保存.故填:应该在阴凉干燥处密封保存.
点评:本题主要考查了物质的物理性质、化合价及其保存物质的方法等方面的知识.

练习册系列答案
相关题目
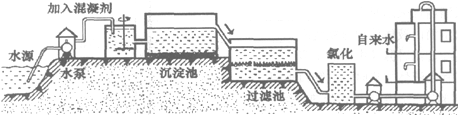
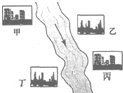 HCl中的一种.某环保小组对河水监测时发现:甲处河水呈无色;乙处河水呈红褐色;丙处河水由浑变清;丁处产生气泡,河水澄清.请回答:
HCl中的一种.某环保小组对河水监测时发现:甲处河水呈无色;乙处河水呈红褐色;丙处河水由浑变清;丁处产生气泡,河水澄清.请回答: