题目内容
【题目】探究下列问题:
(1)镁将成为21世纪重要的轻型环保材料,我国含有非常丰富的镁资源.老师每次做有关镁的实验时都会强调:镁是一种银白色有金属光泽的金属.但拿出的镁条总是有一层灰黑色的“外衣“,这层灰黑色的外衣是什么物质呢?
猜想:小明认为可能是MgO;
小赵认为可能是Mg2(OH)2CO3;
小花认为可能是Mg(OH)2 .
小赵认为小明的猜想是错误的,其理由是 .
实验探究:小赵按图所示装置进行实验,发现试管口有液滴出现,澄清石灰水变浑浊,同时试管内生成白色固体.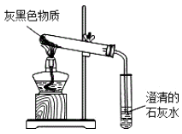
实验分析:实验后,小赵认为小花的猜测也是错误的,其理由是 .
查阅资料得出结论:Mg(OH)2和Mg2(OH)2CO3都可以加热分解,产物均为氧化物,据此请你写出Mg2(OH)2CO3加热分解的化学方程式.
(2)已知某金属粉末中除含有Al外还含有一定量的Fe和Cu,为证明Al、Fe和Cu的存在并测定其中Al的质量分数,某化学兴趣小组的同学展开了如下的实验探究.资料在线:Al与氢氧化钠溶液反应生成溶于水的偏铝酸钠和氢气(反应的化学方程式为:2Al+2H2O+2NaOH=2NaAlO2+3H2↑),Fe和Cu不与氢氧化钠溶液反应.
化学兴趣小组的同学讨论了证明金属粉末中存在Al、Fe和Cu的实验设计,下列他们的说法正确的是( )
A.先加氢氧化钠溶液后加稀盐酸
B.加入的溶液都要过量
C.反应过程中溶液始终是无色
D.充分反应到最后,无固体残留
(3)
为探究该金属粉末中Al的质量分数,取20g该金属粉末,把100g氢氧化钠溶液平均分成5份依次加入,充分反应后,过滤出固体,将其洗涤、干燥、称量.实验过程中得到的部分数据与图象如下图:
加NaOH溶液的次数 | 第一次 | 第二次 | 第三次 | … |
剩余固体的质量/g | 17.3 | n | 11.9 | … |

Ⅰ.分析以上数据可知,上表中n的值为;
Ⅱ.该金属粉末中Al的质量分数为%
Ⅲ.列式计算:第一次参加反应氢氧化钠的质量?
【答案】
(1)小赵认为小明的猜想是错误的,其理由是氧化镁为白色固体与水缓慢反应生成氢氧化镁,而信息中为灰黑色物质;赵认为小花的猜想也是错误的,其理由是样品分解生成的二氧化碳使澄清石灰水变浑浊,而氢氧化镁不会生成二氧化碳,则Mg2(OH)2CO3分解生成MgO、CO2、H2O,反应为Mg2(OH)2CO3![]() 2MgO+CO2↑+H2O
2MgO+CO2↑+H2O
(2)A,B
(3)
I.上表中n的值为14.6
II.由图中可知,该金属粉末中Al的质量分数为![]()
![]() =70%;
=70%;
III.设第一次参加反应氢氧化钠的质量为x
2Al+2H2O+2NaOH=2NaAlO2+3H2↑
54 80
2.7g x
![]()
![]()
解得x=4g
答:氢氧化钠溶液中溶质质量分数为13.3%第一次参加反应氢氧化钠的质量2.7g.
【解析】(1)小赵认为小明的猜想是错误的,其理由是氧化镁为白色固体与水缓慢反应生成氢氧化镁,而信息中为灰黑色物质;小赵认为小花的猜想也是错误的,其理由是样品分解生成的二氧化碳使澄清石灰水变浑浊,而氢氧化镁不会生成二氧化碳,则Mg2(OH)2CO3分解生成MgO、CO2、H2O,反应为Mg2(OH)2CO3![]() 2MgO+CO2↑+H2O;(2)②要证明铜和铁的存在,要先将铝除尽避免干扰,先加过量的氢氧化钠溶液除去铝,后加过量的稀盐酸与铁充分反应,如果有气泡冒出,并且溶液变浅绿色,说明有铁,最后还有紫红色色固体说明有铜.故选AB
2MgO+CO2↑+H2O;(2)②要证明铜和铁的存在,要先将铝除尽避免干扰,先加过量的氢氧化钠溶液除去铝,后加过量的稀盐酸与铁充分反应,如果有气泡冒出,并且溶液变浅绿色,说明有铁,最后还有紫红色色固体说明有铜.故选AB
(3)I.上表中n的值为14.6
II.由图中可知,该金属粉末中Al的质量分数为![]()
![]() =70%;
=70%;
III.设第一次参加反应氢氧化钠的质量为x
2Al+2H2O+2NaOH=2NaAlO2+3H2↑
54 80
2.7g x![]()
![]()
解得x=4g
答:氢氧化钠溶液中溶质质量分数为13.3%第一次参加反应氢氧化钠的质量2.7g.
