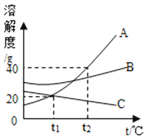
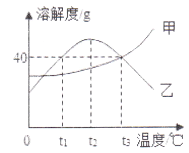
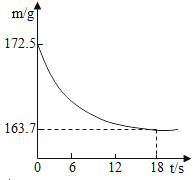
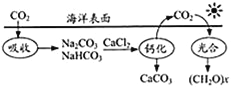
题目内容
【题目】某同学欲配置40g质量分数为9%的氯化钠溶液,全部操作过程如下图所示,看图回答下列问题:

(1) 实验中使用玻璃棒的目的是_______________。
(2)如果所配得的溶液溶质的质量分数比小于9%,你认为可能的原因有(写一条):______ 。
【答案】 加速溶解 将氯化钠倒入烧杯时有氯化钠洒出;量液时仰视读数;(合理均可)
【解析】本题考查了一定溶质质量分数的溶液的配制。
(1)溶解操作中用玻璃棒进行搅拌,可以加快食盐的溶解,直到固体物质全部溶解;
(2)如果所配得的溶液溶质的质量分数小于9%,要从食盐的量少和水的量多分析:造成食盐量不足的原因有:药品和砝码位置颠倒、将食盐移入烧杯时未全部倒入、溶解时搅拌不彻底还有食盐未溶解;造成量水的体积偏大的操作可能是量取水时仰视读数等。

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案【题目】在学习盐的性质时,某组同学将碳酸钠溶液和一瓶标签破损的溶液M(如图)进行反应,有白色沉淀产生,过滤后得到澄清滤液。同学们对该实验进行了一系列的研究。
探究一:M溶液中的溶质是什么?
(1)【提出猜想】该组同学认为M溶液的溶质有两种可能:①是______;②是CaCl2。
(2)【设计实验】同学们设计了如下方案并进行实验:
实验操作 | 实验现象 | 实验结论 |
取少量M溶液于试管中,向其中滴加________ | ________________ | 猜想①正确 |
则碳酸钠溶液与M溶液反应的方程式为_____________________。
探究二:过滤后澄清滤液中会有哪些溶质?
(1)【提出猜想】猜想一:NaOH 和Na2CO3;猜想二:__________;猜想三:NaOH。
(2)【实验验证】同学们针对“猜想一”进行了如下实验:
实验操作 | 实验现象 | 实验结论 |
取样于试管中,滴加少量的稀盐酸 | 无气体产生 | 猜想一不成立 |
他们的实验结论是否正确?________,理由是_________________。
(3)【继续探究】设计实验方案确定滤液中溶质的组成。
实验操作 | 实验现象 | 实验结论 |
分别取少量滤液于A、B两支试管中,A中加入CaCl2溶液,B中加入____________溶液 | __________________ | 猜想三成立 |