题目内容
【题目】取含铁、氧两种元素的固体样品11.6g,通入足量CO并充分加热,将产生的气体通入足量澄清石灰水,充分反应后,得沉淀20.0g。该固体的组成不可能是
A. Fe2O3 B. Fe3O4 C. Fe和Fe2O3 D. FeO和Fe2O3
【答案】A
【解析】
解:设二氧化碳质量为x,
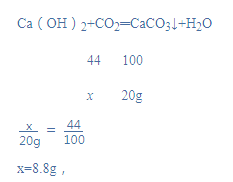
二氧化碳中氧元素质量为:8.8g×![]() ×100%=6.4g,
×100%=6.4g,
则含铁、氧两种元素的固体样品中氧元素质量为:6.4g÷2=3.2g,
含铁、氧两种元素的固体样品中氧元素质量分数为:![]() ×100%=27.6%,
×100%=27.6%,
氧化铁、四氧化三铁、氧化亚铁中氧元素质量分数分别为:
![]() ×100%=30%、
×100%=30%、![]() ×100%=27.6%、
×100%=27.6%、![]() ×100%=22.2%,
×100%=22.2%,
由计算可知,该固体的组成可能是Fe3O4、Fe和Fe2O3、FeO和Fe2O3,不可能是Fe2O3。故选A。

练习册系列答案
相关题目
【题目】某兴趣小组同学对实验室用双氧水制备氧气的条件进行如下探究实验。
(1)甲探究了影响双氧水分解速度的某种因素。实验数据记录如下:
双氧水的质量 | 双氧水的浓度 | MnO2的质量 | 相同时间内产生O2体积 | |
Ⅰ | 50.0g | 1% | 0.1g | 9 mL |
Ⅱ | 50.0g | 2% | 0.1g | 16 mL |
Ⅲ | 50.0g | 4% | 0.1g | 31 mL |
本实验中,测量O2体积的装置可选择下图中___________(选填“a”、“b”、“c”)。
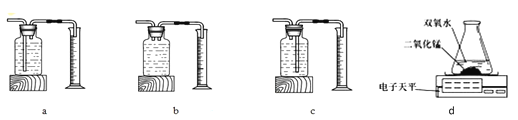
实验结论:在相同条件下,___________________________,双氧水分解得越快。
(2)乙用d图装置进行实验,通过比较_______________________也能达到实验目的。