题目内容
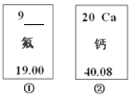
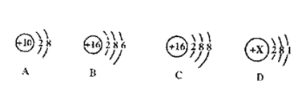
【题目】苏泊尔不锈钢锅具在近日经检测发现:制造材料不锈钢中添加锰金属含量超过国家标准。锰在不锈钢中主要起耐磨性作用,锰(Mn)在金属活动性顺序中位于铝和锌之间,则下列反应不正确的是( )
A.Mn + H2SO4 = MnSO4+H2↑B.Mg + MnSO4 = MgSO4+ Mn
C.Fe + MnSO4= FeSO4+ MnD.Mn + CuSO4 = MnSO4+ Cu
【答案】C
【解析】
A、锰(Mn)在金属活动性顺序中位于铝和锌之间,说明锰在金属活动性顺序里,位于氢之前,锰能与稀硫酸反应生成硫酸锰和氢气,该反应的化学方程式为:![]() ,不符合题意;
,不符合题意;
B、锰(Mn)在金属活动性顺序中位于铝和锌之间,说明锰在金属活动性顺序里,位于镁之后,镁能与硫酸锰反应生成硫酸镁和锰,该反应的化学方程式为:![]() ,不符合题意;
,不符合题意;
C、锰(Mn)在金属活动性顺序中位于铝和锌之间,说明锰在金属活动性顺序里,位于铁之前,铁不能与硫酸锰反应,符合题意;
D、锰(Mn)在金属活动性顺序中位于铝和锌之间,说明锰在金属活动性顺序里,位于铜之前,锰能与硫酸铜反应生成硫酸锰和铜,该反应的化学方程式为:![]() ,不符合题意。
,不符合题意。
故选C。

 名校课堂系列答案
名校课堂系列答案【题目】工业上用闪锌矿(主要含ZnS,还含PbS等杂质)制备锌的流程如下(部分产物略去):
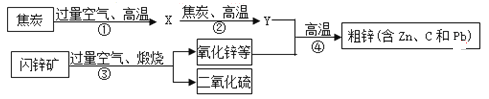
(1)X的化学式是_______,图中用过量空气的目的是_________。
(2)①~④中属于化合反应的是______。
(3)Zn______(填“能”或“不能)与PbCl2溶液反应。
(4)写出反应③中生成ZnO的化学方程式_________。
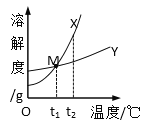
(5)结合下表数据设计:从粗锌中分离出纯锌的方案是_________。
物质 | Zn | Pb | C |
沸点℃ | 907 | 1749 | 4827 |
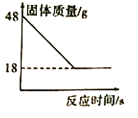
(6)反应②中固体质量随反应时间的变化图示如下图,计算产生Y的质量__________。(写出必要的计算过程)
【题目】硝酸(HNO3)是实验室常见的一种酸,实验小组对硝酸的某些性质进行研究。
I.挥发性
(实验1)取一瓶质量分数68%的浓硝酸,打开瓶盖,遇潮湿的空气,瓶口可以看到__________。
II.不稳定性
(查阅资料1)硝酸是无色液体,见光或受热分解生成红棕色的NO2气体。
(1)硝酸分解的化学方程式为:4HNO3![]() 4NO2↑+O2↑+___。
4NO2↑+O2↑+___。
(实验2)取3份浓度和体积均相同的浓硝酸分别放入3支试管中,塞好塞子,放置在室外阳光充足的地方(气温为26 ℃)。记录溶液上方的气体颜色随时间的变化情况。
实验编号 | ① | ② | ③ |
实验条件 |
|
|
|
实验现象 | 6分钟出现浅红棕色 15分钟红棕色比较明显 30分钟红棕色非常明显 | 60分钟无明显变化 | 3分钟出现浅红棕色 6分钟红棕色比较明显 10分钟红棕色非常明显 |
(2)实验①、②对比是研究对浓硝酸稳定性的影响__________________________________。
(3)实验①、③对比可得出的结论是__________________________________________。
III.酸性
(查阅资料2)硝酸能够与金属氧化物反应生成盐和水。
(实验3)向氧化铜粉末中加入硝酸,能够观察到的现象是_________________________。
IV.氧化性
(查阅资料3)浓硝酸在加热条件下能与木炭发生反应。C+4HNO3(浓)![]() 4NO2↑+ CO2↑+2H2O
4NO2↑+ CO2↑+2H2O
(实验4)如图所示,将红热的木炭伸到浓硝酸上方,观察到有红棕色气体产生。请解释生成该红棕色气体的原因可能有:
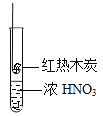
①___________________________________________________。
②___________________________________________________。