题目内容
【题目】氢氧燃料电池具有能量转化率高、无污染等特点,近年来逐渐运用于航天、汽车等领域.其工作原理是:H2和O2反应时将化学能转化为电能.
【提出问题】H2一定要在O2中燃烧才能产生电能吗?
【实验步骤】重庆一中初三某化学兴趣小组同学群策群力,据实验目的设计了如图1所示装置: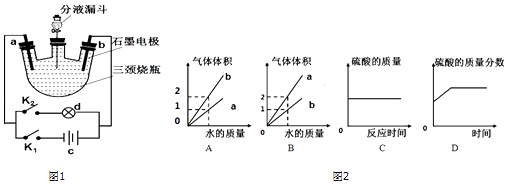
步骤1.向分液漏斗中注入一定浓度的硫酸溶液(或氢氧化钾溶液)
步骤2.闭合K1 , 断开K2 , 一分钟后观察三颈瓶中的现象
步骤3.闭合K2 , 断开K1 , 记录用电器工作时间
步骤4.将d处小风扇依次更换为小灯泡,发光二极管,重复步骤2、3
【实验分析】
步当闭合K1 , 断开K2 , 一分钟后,a,b处有大量气泡产生….
(1)三颈中发生的化学反应式为 ,
该实验可得到的结论有(填序号);
①水由氢气和氧气组成 ②水由氢氧原子构成
③水由氢氧元素组成 ④水由氢氧两个元素组成
(2)下列对分液漏斗中的现象及作用描述正确的是;
①液面下降,调节压强 ②液面下降,控制反应速率
③液面上升,调节压强 ④液面上升,控制反应速率
(3)如图2图象不符合实验事实的是(填序号);
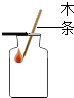
(4)要区分a、b处气体,最好选用的方法是 , 若用ρ(H2)、ρ(O2)分别表示H2、O2的密度,则反应后生成物的分子中,H,O原子个数比的计算式为[用ρ(H2)、ρ(O2)来表示].
(5)步骤3、4,闭合K2 , 断开K1 , 各用电器工作时间如下表:
溶液 | 各用电器工作时间/秒 | ||
小风扇 | 2.5V小灯泡 | 发光二极管 | |
Xg/L H2SO4溶液 | 65 | 55 | >480 |
Yg/L KOH溶液 | 29 | 10 | 10 |
比较电解H2SO4溶液、KOH溶液,哪种获得的电能更多? , 则XY(填“>”、“<”或“=”).
(6)【实验结论】通过分析知:氢氧燃料电池(填“一定”、“不一定”或“一定不”)在点燃条件下才能放电.
【答案】
(1)2H2O ![]() 2H2↑+O2↑;③
2H2↑+O2↑;③
(2)③
(3)A
(4)用燃着的木条;32ρ(H2):ρ(O2)
(5)电解H2SO4溶液;>
(6)不一定
【解析】解:(1)水在电解的过程中分解产生了氢气和氧气,故该反应的化学方程式2H2O ![]() 2H2↑+O2↑.电解水实验可得到的结论是:水是由氢、氧两种元素组成的等,故选:C.(2)因为水在电解的过程中分解产生了氢气和氧气,装置中压强变大,水被压入分液漏斗中,分液漏斗可以调节压强,故选C;(3)电解水时,a端连接电源的负极,产生氢气;b端连接电源的正极,产生氧气,且两者的体积之比大约是2:1,所以A错B对;过程中硫酸只是增强溶液的导电性,其反应前后的质量不变,故C对,由于随着水的电解,水的质量不断减小,硫酸溶液的溶质质量分数不断增大,当反应停止时硫酸质量分数不变,故D对,故选A.(4)氧气能使燃着的木条燃烧更旺,氢气能被燃着的木条点燃,区分二者的最好选用的方法是用燃着的木条;H2、O2的质量比为ρ(H2)×2:ρ(O2)×1,H2、O2的分子数之比为:
2H2↑+O2↑.电解水实验可得到的结论是:水是由氢、氧两种元素组成的等,故选:C.(2)因为水在电解的过程中分解产生了氢气和氧气,装置中压强变大,水被压入分液漏斗中,分液漏斗可以调节压强,故选C;(3)电解水时,a端连接电源的负极,产生氢气;b端连接电源的正极,产生氧气,且两者的体积之比大约是2:1,所以A错B对;过程中硫酸只是增强溶液的导电性,其反应前后的质量不变,故C对,由于随着水的电解,水的质量不断减小,硫酸溶液的溶质质量分数不断增大,当反应停止时硫酸质量分数不变,故D对,故选A.(4)氧气能使燃着的木条燃烧更旺,氢气能被燃着的木条点燃,区分二者的最好选用的方法是用燃着的木条;H2、O2的质量比为ρ(H2)×2:ρ(O2)×1,H2、O2的分子数之比为: ![]() :
: ![]() =32ρ(H2):ρ(O2);反应后生成物的分子中,H、O原子个数比32ρ(H2)×2:ρ(O2)×2=32ρ(H2):ρ(O2);(5)由表中数据可知,电解H2SO4溶液各用电器工作时间更长,获得的电能更多,意味着电解时反应速度更快,溶液的导电性更好,所以H2SO4溶液浓度大于KOH溶液.【实验结论】闭合K2 , 断开K1 , 用电器就可以工作,说明氢氧燃料电池不一定在点燃条件下才能放电.
=32ρ(H2):ρ(O2);反应后生成物的分子中,H、O原子个数比32ρ(H2)×2:ρ(O2)×2=32ρ(H2):ρ(O2);(5)由表中数据可知,电解H2SO4溶液各用电器工作时间更长,获得的电能更多,意味着电解时反应速度更快,溶液的导电性更好,所以H2SO4溶液浓度大于KOH溶液.【实验结论】闭合K2 , 断开K1 , 用电器就可以工作,说明氢氧燃料电池不一定在点燃条件下才能放电.
所以答案是:(1)2H2O ![]() 2H2↑+O2↑;C.(2)C;(3)A;(4)用燃着的木条;32ρ(H2):ρ(O2);(5)电解H2SO4溶液;>;(6)【实验结论】不一定.
2H2↑+O2↑;C.(2)C;(3)A;(4)用燃着的木条;32ρ(H2):ρ(O2);(5)电解H2SO4溶液;>;(6)【实验结论】不一定.
【考点精析】关于本题考查的书写化学方程式、文字表达式、电离方程式,需要了解注意:a、配平 b、条件 c、箭号才能得出正确答案.

【题目】下列有关物质-性质-用途的叙述中,用途与性质不相关的是
物质 | 性质 | 用途 | |
A | 氧气 | 能与许多物质反应并放出热量 | 助燃剂 |
B | 一氧化碳 | 可燃性 | 冶炼金属 |
C | 氮气 | 化学性质不活泼 | 保护气 |
D | 活性炭 | 吸附性 | 防毒面具 |
A. A B. B C. C D. D