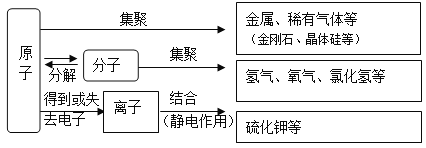
题目内容
【题目】根据下图回答有关问题:
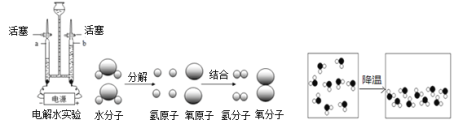
图1 图2 图3
(1)图1为电解水的实验装置图,接通电源观察两电极都有气泡产生。通电一段时间后,玻璃管a收集到的气体是 ,点燃a中的气体会产生 火焰。
(2)图2为水分解的微观过程:保持水的化学性质的最小粒子是_______________(填具体粒子名称),水分解过程中,没有发生变化的粒子是 (填具体粒子名称)。
(3)电解水的实验说明了水是由 组成。
(4)已知同温同压下,气体的体积比决定于气体的分子数之比。该实验中能说明水的化学式为“H2O”的实验现象是 。
(5)从微观角度解释图2和图3的本质区别是 。
【答案】(1)氢气(H2),淡蓝色。
(2)水分子,氢原子和氧原子。
(3)氢元素和氧元素。
(4)氢气和氧气的体积比为2:1。
(5)分子本身是否发生变化(图2分子种类发生了变化,图3分子种类没有变化)
【解析】
试题分析:(1)电解水实验中与正极产生的是氧气,用带火星的小木条检验,负极产生的是氢气,可用燃烧法检验,正负两极气体的体积比为1:2 ,质量比为8:1 ,该实验能得出水是由氢元素和氧元素组成的结论;由图可知a端生成的是氢气,氢气燃烧产生淡蓝色火焰;
(2)水是由水分子构成的,故保持水化学性质的最小粒子是水分子;水分解的实质是水分子分解生成氢原子和氧原子,氢原子和氧原子重新组合形成新的氢分子和氧分子,故不变的是氢原子和氧原子;
(3)水电解生成氢气和氧气,根据质量守恒定律化学反应前后元素的种类不变,可知水是由氢元素和氧元素组成的结论;
(4)生成的氢气和氧气的体积为为1:2,根据气体的体积比决定于气体的分子数之比,故水的化学式为H2O;
(5)图2发生的化学变化,图3发生的是物理变化。化学变化会生成新分子,即分子的种类发生了变化,物理变化中分子的种类没有变,变的是分子间的间隔。