题目内容
小亮同学学习了石灰石的主要成分为碳酸钙后,找到一块石灰石,取15g该石灰石样品(杂质不溶于水且不与酸反应)与足量的稀盐酸反应,进行实验探究.他将产生的气体依次通过浓氢氧化钠溶液和澄清石灰水溶液,当反应中无气体产生时测得装有氢氧化钠溶液的试剂瓶的质量增加了4.7g;装有澄清石灰水溶液的集气瓶的质量没有发生变化且无明显现象.有关数据如下:
请你回答:
(1)15g样品最多生成二氧化碳气体的质量为 g
(2)所用稀盐酸的溶质的质量分数是多少?写出计算过程.

请你回答:
(1)15g样品最多生成二氧化碳气体的质量为
(2)所用稀盐酸的溶质的质量分数是多少?写出计算过程.
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:综合计算(图像型、表格型、情景型计算题)
分析:(1)通过观察A中剩余固体质量和加入盐酸的关系可知,当加入盐酸的质量大于m2g时,剩余固体的质量不在减少,由题意可知剩余固体是杂质,杂质的质量是5g,则可知石灰石样品中碳酸钙的质量;由碳酸钙的质量,根据碳酸钙和盐酸反应的方程式所表示的质量关系,就可以求出15g样品最多能生成二氧化碳气体的质量,还可以求出参加反应的稀盐酸中溶质的质量;
(2)根据质量守恒定律,由反应后溶液的质量、参加反应的碳酸钙的质量和生成的二氧化碳的质量,可以求出参加反应的盐酸溶液的质量,在根据溶质的质量分数的计算公式就可以求出用稀盐酸的溶质质量分数.
(2)根据质量守恒定律,由反应后溶液的质量、参加反应的碳酸钙的质量和生成的二氧化碳的质量,可以求出参加反应的盐酸溶液的质量,在根据溶质的质量分数的计算公式就可以求出用稀盐酸的溶质质量分数.
解答:解:根据第一个图中固体样品中碳酸钙全反应固体的质量减轻了10g,所以样品中碳酸钙的质量为10g.
设生成的二氧化碳的质量为x,参加反应的盐酸中溶质的质量为y
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 44
10g y x
=
,
x=4.4g
=
y═7.3g
根据题意,A中余下的质量110.3克应该是盐酸的质量加上石灰石样品的质量减去A中挥发走的水和二氧化碳的质量,即B增重的质量4.7克,所以列式为:m2+15g-4.7g=110.3g,m2=100g.
所用稀盐酸的溶质质量分数是:
×100%═7.3%.
答案:
(1)4.4;
(2)所用稀盐酸的溶质质量分数是7.3%.
设生成的二氧化碳的质量为x,参加反应的盐酸中溶质的质量为y
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 44
10g y x
| 100 |
| 10g |
| 44 |
| x |
x=4.4g
| 100 |
| 73 |
| 10g |
| y |
y═7.3g
根据题意,A中余下的质量110.3克应该是盐酸的质量加上石灰石样品的质量减去A中挥发走的水和二氧化碳的质量,即B增重的质量4.7克,所以列式为:m2+15g-4.7g=110.3g,m2=100g.
所用稀盐酸的溶质质量分数是:
| 7.3g |
| 100g |
答案:
(1)4.4;
(2)所用稀盐酸的溶质质量分数是7.3%.
点评:本题主要考查了有关溶质质量分数与化学方程式的综合计算,计算的难点是反应前后有关溶液质量的分析判定,判定的依据就是质量守恒定律.

练习册系列答案
相关题目
用托盘天平称量6.2g食盐时,若指针偏向左边,则应( )
| A、在左盘增加称量物 |
| B、移动游码使天平平衡 |
| C、减少左盘上的食盐 |
| D、增加砝码使天平平衡 |
下列微粒结构示意图表示阳离子的是( )
A、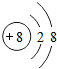 |
B、 |
C、 |
D、 |