题目内容
【题目】回答与金属有关的问题:
(1)比较铜与黄铜的硬度,采用的方法是______________________________;
(2)为比较铁、铜的活动性,可以将铁丝放入硫酸铜溶液中,只要观察到______________________________现象,就可以证明铁比铜活动性强;
(3)炼铁的核心反应中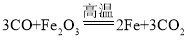 , 发生还原反应的物质是___________________________。
, 发生还原反应的物质是___________________________。
(4)向CuCl2溶液中加入一定量的锌粉和铁粉,充分反应后过滤,得到滤渣和滤液。向滤渣中滴加稀盐酸,有气泡产生,则滤渣中一定含有的物质是___________________________。
【答案】互相刻划 铁表面有红色物质 Fe2O3 Cu、Fe
【解析】
(1) 用互相刻划的方法可确定铜与黄铜的硬度,硬度大的能在硬度小的金属片上刻划出痕迹;
(2) 将铁丝浸入硫酸铜溶液中,一段时间后,能观察到的现象是铁丝上有红色的物质;通过本实验可得到金属铁比铜的活动性强;
(3)在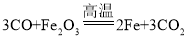 ,中,Fe2O3失去氧,变成铁,发生了还原反应;
,中,Fe2O3失去氧,变成铁,发生了还原反应;
(4) 铁、锌的金属活动性比铜强,且锌比铁活泼,在氯化铜溶液中加入一定质量的锌粉和铁粉,锌先与氯化铜溶液反应生成氯化锌溶液和铜,锌反应完,铁才能与氯化铜溶液反应生成氯化亚铁溶液和铜,向滤渣中滴加稀盐酸,有气泡产生,则滤渣中一定有铁和铜,可能有锌。

 阅读快车系列答案
阅读快车系列答案【题目】某课外兴趣小组对实验室中的一瓶稀硫酸样品进行分析。他们分别用100 g稀硫酸与不同质量的锌粒(含杂质,杂质不与稀硫酸反应)反应,三次实验的数据如下表。
实验次数 | 1 | 2 | 3 |
加入锌粒的质量(g) | 4 | 8 | 12 |
充分反应后剩余物质的总质量(g) | 103.9 | 107.8 | 111.8 |
请回答下列问题:
(1)第______次实验,锌粒与稀硫酸恰好完全反应。
(2)计算稀硫酸的溶质质量分数为________(写出计算过程)。