题目内容
【题目】硝酸铵是一种化肥,化学式是NH4NO3.试计算:
(1)硝酸铵中氮元素的质量分数;
(2)60kg硝酸铵中含有多少氮元素;
(3)多少千克尿素[CO(NH2)2]与40kg硝酸铵中所含氮元素的质量相当?
(4)此化肥中硝酸铵的质量分数为40%,则化肥样品中氮元素的质量分数为多少(精确到0. 1%)?
【答案】(1)35% (2) 21Kg (3) 30kg (4) 14.0%
【解析】(1)某元素质量分数=![]() ×100%;(2)化合物中某元素的质量=该化合物的质量×该化合物中该元素的质量分数;(3)先求出40kg硝酸铵中所含氮元素的质量,再根据氮元素的质量÷尿素中氮元素的质量分数求出尿素的质量;(4)混合物中某元素的质量分数=纯净物中该元素的质量分数×混合物中该纯净物的纯度。
×100%;(2)化合物中某元素的质量=该化合物的质量×该化合物中该元素的质量分数;(3)先求出40kg硝酸铵中所含氮元素的质量,再根据氮元素的质量÷尿素中氮元素的质量分数求出尿素的质量;(4)混合物中某元素的质量分数=纯净物中该元素的质量分数×混合物中该纯净物的纯度。
解:(1) 某元素质量分数=![]() ×100%,所以硝酸铵中氮元素的质量分数是:
×100%,所以硝酸铵中氮元素的质量分数是: ![]() ×100%=35%;(2)化合物中某元素的质量=该化合物的质量×该化合物中该元素的质量分数,所以60Kg硝酸铵中含氮元素的质量是:60Kg×35%=21Kg;(3) 40kg硝酸铵中所含氮元素的质量=40kg×35%=14kg。14kg÷
×100%=35%;(2)化合物中某元素的质量=该化合物的质量×该化合物中该元素的质量分数,所以60Kg硝酸铵中含氮元素的质量是:60Kg×35%=21Kg;(3) 40kg硝酸铵中所含氮元素的质量=40kg×35%=14kg。14kg÷![]() =30kg;(4)
=30kg;(4) ![]() ×100%×40%=14.0%。答:(1)硝酸铵中氮元素的质量分数为35%; (2)60kg硝酸铵中含有21Kg氮元素; (3) 30kg千克尿素[CO(NH2)2]与40kg硝酸铵中所含氮元素的质量相当; (4)此化肥中硝酸铵的质量分数为40%,则化肥样品中氮元素的质量分数为14.0%。
×100%×40%=14.0%。答:(1)硝酸铵中氮元素的质量分数为35%; (2)60kg硝酸铵中含有21Kg氮元素; (3) 30kg千克尿素[CO(NH2)2]与40kg硝酸铵中所含氮元素的质量相当; (4)此化肥中硝酸铵的质量分数为40%,则化肥样品中氮元素的质量分数为14.0%。

 阅读快车系列答案
阅读快车系列答案【题目】已知:A与一定量的B在点燃的条件下反应,生成物为C和D.
物质 | A | B | C | D |
|
微观示意图 |
|
|
|
|
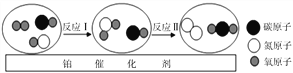
则A物质中“![]() ”的元素化合价为 ______ ,该反应的化学方程式为 ______ .若在反应中继续通入足量的B,则C可进一步完全转化为
”的元素化合价为 ______ ,该反应的化学方程式为 ______ .若在反应中继续通入足量的B,则C可进一步完全转化为![]() 则该反应的总化学方程式为 ______ ;当有34gA完全反应时,生成
则该反应的总化学方程式为 ______ ;当有34gA完全反应时,生成![]() 的质量为 ______ g.
的质量为 ______ g.
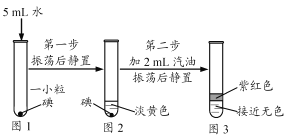
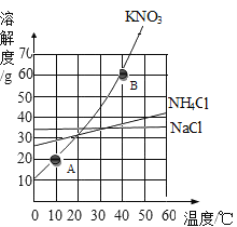
【题目】为了探究相同条件下同种溶质在不同溶剂中的溶解性,某兴趣小组同学进行如下两组实验。(提示:本实验所川汽油与KMnO4、碘均不发生化学反应)
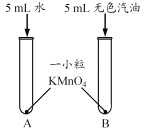
【实验l】KMnO4晶体在不同溶剂中的溶解实验
根据实验步骤、实验操作图示填写相关实验现象。
实验步骤 | 实验操作图示 | 实验操作及现象 |
步骤1 |
| 振荡后静置: |
步骤2 |
| 将步骤1中A试管内溶液倒人B试管中,振荡后静置:(2)B试管中观察到的现象为__________。 |
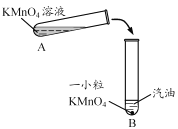
【实验2]碘在不同溶剂中的溶解实验
根据实验操作图示回答相关问题。
实验操作图示 | 实验结论或解释 |
| (3)由图2所示现象叮知:碘_____(选填“不”、“微”或“易”)溶于水 |
【反思与应用】
(5)①碘易溶于酒精。若【实验2】中汽油用酒精代替,振荡后静置,最终所得液体______(选填“分层”或“小分层”)。
②“从稀碘水巾提取碘”是“海带提碘”工艺巾的一个重要步骤,其原理类似【实验2]中第二步操作。工业实际生产时使用其他挥发性液体代替汽油,这种挥发性液体必须具备的条件是________。