题目内容
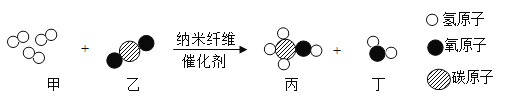
【题目】某兴趣小组同学用木炭粉还原氧化铁,一段时间后发现剩余固体中还有红色粉末。甲同学取少量剩余固体加入5% 的H2O2溶液中,发现有大量气泡迅速放出,小组决定对剩余固体的组成及催化性成分进行探究。乙同学取少量剩余固体在空气中灼烧,并在上方罩一个内壁涂有澄清石灰水的烧杯(如下图),发现烧杯内壁的澄清石灰水不变浑浊。
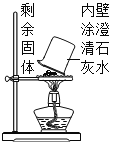
(1)乙同学能得出的探究结论是________________。
丙同学接着又进行了如下探究:
(提出问题)剩余固体中的什么物质是H2O2分解的催化剂?
(提出猜想)猜想Ⅰ:铁是H2O2分解的催化剂。猜想Ⅱ:氧化铁是H2O2分解的催化剂。
(实验探究)实验过程如下:
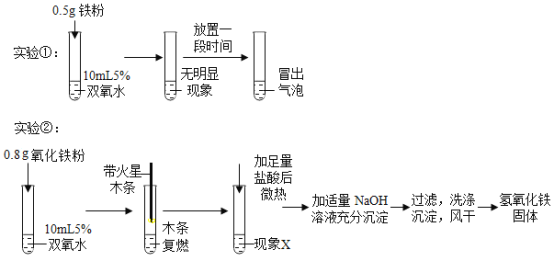
(实验分析)
(2)由实验①可得出的结论是:猜想Ⅰ____________(填“成立”或“不成立”)。实验②中,“木条复燃”的现象能说明有_______________生成,猜想Ⅱ可能成立。
(3)在后续实验探究中,可能观察到的现象X是固体全部溶解,溶液_____________;加入适量NaOH溶液生成沉淀的化学方程式为____________________________。
(实验反思)
(4)进行实验①时,放置一段时间后会“冒出气泡”的原因可能是_____________。
(5)要证明猜想Ⅱ一定成立,需要确定实验②在进行“木条复燃”检验后,试管中固体的_____和________都没有改变。丙同学从“加入足量盐酸”到风干得到“氢氧化铁固体”的后续探究方法设计________________(选填“能”或“不能”)得出猜想Ⅱ一定成立的结论。
【答案】剩余固体中不含木炭粉 不成立 氧气 呈黄色 ![]() 有少量铁被过氧化氢氧化生成了氧化铁(或铁被过氧化氢氧化的产物具有催化作用) 化学性质 质量 不能
有少量铁被过氧化氢氧化生成了氧化铁(或铁被过氧化氢氧化的产物具有催化作用) 化学性质 质量 不能
【解析】
(1)取少量剩余固体在空气中灼烧,并在上方罩一个内壁涂有澄清石灰水的烧杯,澄清石灰水不变浑浊,说明无二氧化碳生成,说明剩余固体中不含木炭粉;
实验
(2)实验①:向双氧水中加入铁粉,无明显现象,说明铁不能改变双氧水的反应速率,铁无催化作用,故猜想Ⅰ不成立;
氧气具有助燃性,能使带火星的木条复燃,实验②中“木条复燃”的现象能说明有氧气生成,猜想Ⅱ可能成立;
(3)加入盐酸,氧化铁能与盐酸反应生成氯化铁和水,氯化铁呈黄色,故可能观察到的现象X是固体全部溶解,溶液呈黄色;
加入氢氧化钠溶液,氢氧化钠能与氯化铁反应生成氢氧化铁和氯化钠,该反应的化学方程式为:![]() ;
;
实验反思:
(4)过氧化氢具有氧化性,可能是铁与过氧化氢反应生成了氧化铁,过氧化氢在氧化铁在催化下分解为水和氧气,因此放置一段时间后会“冒出气泡”,故填:有少量铁被过氧化氢氧化生成了氧化铁(或铁被过氧化氢氧化的产物具有催化作用);
(5)催化剂在化学反应前后,质量和化学性质不变,故为验证猜想Ⅱ一定成立,需要检验试管中固体的质量和化学性质都没有改变;
要想得出猜想Ⅱ一定成立的结论,需要验证氧化铁在反应前后,质量和化学性质不变,加足量稀盐酸,![]() ,加入氢氧化钠:
,加入氢氧化钠:![]() ,过滤,洗涤、风干,得到氢氧化铁固体,可通过氢氧化铁固体的质量推算出氧化铁的质量,但是无法验证氧化铁的化学性质是否改变,故不能得出猜想Ⅱ一定成立的结论。
,过滤,洗涤、风干,得到氢氧化铁固体,可通过氢氧化铁固体的质量推算出氧化铁的质量,但是无法验证氧化铁的化学性质是否改变,故不能得出猜想Ⅱ一定成立的结论。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案【题目】某化工厂生产的纯碱产品中含有少量氯化钠杂质,其产品包装袋上注明:碳酸钠≥93%。为测定该产品中含碳酸钠的质量分数,进行了以下实验:取12.0g纯碱样品放入烧杯中,称得烧杯及所盛纯碱样品的总质量为158.0g,再把120g稀盐酸平均分成四份依次加入样品中,每次均充分反应。实验数据记录如下:
所加盐酸的次数 | 第一次 | 第二次 | 第三次 | 第四次 |
稀盐酸的质量/g | 30 | 30 | 30 | 30 |
烧杯及所盛物质总质量/g | 186.2 | 214.4 | 243.6 | 273.6 |
请你据此分析计算:
(1)第_____次加入的稀盐酸完全反应了。
(2)该产品中碳酸钠的质量分数是否合格?___(要求写出计算过程,结果精确到0.1%)