��Ŀ����
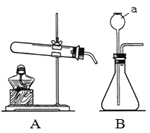
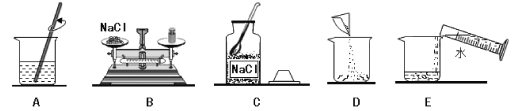
����Ŀ������ʯ���к�һ����������ʱ����Һ��pH��������ʯ�������Ĺ�ϵ��ͼ1��ʾ����ʯ�������ᷴӦ�Ļ�ѧ����ʽΪ_____��������ʯ��mgʱ����Һ�е����ʻ�ѧʽΪ_____��
ij��ѧ�С���ԡ�����ε����ʡ�Ϊ�������̽����ѧϰ��������Ϊ��С���Աһ��������������⣺
��1��С��ͬѧ��ijһǷ��ũ����ȡ��һ��������Ʒ���������������ԣ��Ӿ��úͿ��з��濼�ǣ���ôҪ���������������ԣ�Ӧ��ũ����ʩ��_____���ѧʽ����
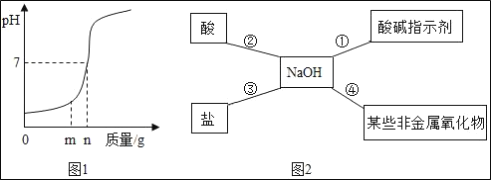
��2��С��ͬѧ����ͼ2�ܽ���NaOH��������ѧ���ʣ���NaOH�����������ܹ�������ѧ��Ӧ����
I��Ϊ����֤��Ӧ����С�콫��ɫ��̪��Һ����NaOH��Һ�У���Һ����ɫ���_____��
II�����ݷ�Ӧ��˵��NaOH�����ܷⱣ�棬�����ڿ�����Ҫ���ʣ��仯ѧ��Ӧ����ʽΪ��_____��
III��Ϊ����֤��Ӧ���ܹ���������ѡ���������_____��
aNa2CO3 bHCl cSO2 dCuSO4��
���𰸡�Ca��OH��2+2HCl��CaCl2+2H2O CaCl2��HCl Ca��OH��2 ��ɫ CO2+2NaOH��Na2CO3+H2O d
��������
��ʯ�������ᷴӦ�����Ȼ�����ˮ��д����Ӧ�Ļ�ѧ����ʽ���ɣ�����ͼ����pHֵ�ı仯�Ǵ�С��7��������7����������Һ������Ϊmgʱ����Һ��pHС��7���ݴ˽��з������
��1����������кͷ�Ӧ������
��2���������ɫ��̪��Һ�����ɺ�ɫ������
�����������Ʊ�������Ϊ��������������еĶ�����̼��Ӧ������
III�����ݸ��ֽⷴӦ��������������ˮ���������������ɡ�
�������ƺ����ᷴӦ�������Ȼ��ƺ�ˮ����Ӧ�Ļ�ѧ����ʽΪ��Ca��OH��2+2HCl��CaCl2+2H2O����������ʯ��mgʱ����Һ��pHС��7����Һ�����ԣ�������ʣ�࣬��Һ�е������������е��Ȼ���ͷ�Ӧ���ɵ��Ȼ��ơ�
��1�����������������ԣ�һ�������ʯ�ң����Ca��OH��2��
��2����.��ɫ��̪��Һ�����ɺ�ɫ��������ɫ��̪��Һ����NaOH��Һ�У���Һ����ɫ��ɺ�ɫ�������ɫ��
���������Ʊ�������Ϊ��������������еĶ�����̼��Ӧ����̼���ƺ�ˮ����Ӧ�Ļ�ѧ����ʽΪ��CO2+2NaOH��Na2CO3+H2O��
III�������������ᷴӦ���ڸ��ֽⷴӦ�����ֽⷴӦ��������������ˮ���������������ɡ�Na2CO3���������Ʋ���Ӧ����A���� HCl���ᣬ�����Σ����������⣬��B���� SO2 ��NaOH��Ӧ���ɣ��������κ��������Ʒ�Ӧ�����Բ��������⣬��C����D��CuSO4���������Ʒ�Ӧ������ͭ���Σ��������⣬����ȷ��
�ʴ�Ϊ��Ca��OH��2+2HCl��CaCl2+2H2O��CaCl2��HCl����1��Ca��OH��2����2��I����ɫ��II�� CO2+2NaOH��Na2CO3+H2O��III�� d

 ������ʱͬ����ϰ��ϵ�д�
������ʱͬ����ϰ��ϵ�д� ѧҵ����һ��һ��ϵ�д�
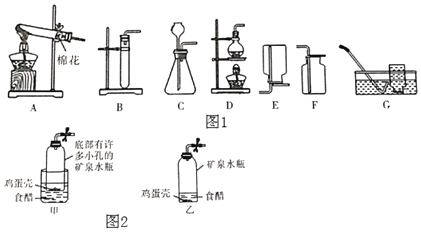
ѧҵ����һ��һ��ϵ�д�����Ŀ����������ʵ��װ��ͼ���ش����⡣
����װ�� | �ռ�װ�� | ϴ��װ�� |
|
|
|
��1��д��ͼ������a������_____��
��2��д��ʵ������ȡCO2�Ļ�ѧ����ʽ_____������װ��ѡ��_____������ĸ�������Ҫ�ռ������CO2����Ҫ����Fװ�ã���Fװ���ڼ�����Լ���_____��ѡ����Ũ�����������������������������_____����ٻ�ڣ��˽��롣
��3��ʵ�������������飬���ü�����ˮ���������ʯ�ҵĹ��������Ƶá��Ƽ���ķ���װ��Ӧѡ��_____������ĸ��װ�ã��ռ������ѡ��C��Eװ�ã��ɴ��ƶϼ�����е�����������_____��
��4����ʵ������п��ϡ������ȡ��������֤���ȼ�ԣ�ʵ������ǣ���װ���������װ�������ԡ�װ��ҩƷ�Ʊ�������_____����ȼ��
��������������������Լ����Ϊ�����Դ�㷺ʹ�õ�ԭ��֮һ,��ѧ�Ҹ������������������ɫ��������������Ⱦ���������ĸ���,���з����ɻ������ɫ����������_____��
A�ÿ�ʯ����п������,�����Ӧ B���÷��ܡ�ˮ������,�ٵ��ˮ
C����úȼ�շ���,�ٵ��ˮ D�ڴ���������,����̫���ܹ��ˮ