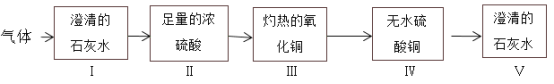
题目内容
【题目】小聪同学家新换了水龙头,从说明书上了解到该水龙头是铜质镀铬。好奇的小聪想探究铬(Cr)与常见金属铁、铜的活动性强弱,邀请你一同参加。
(作出猜想)
猜想1.Cr>Fe>Cu; 猜想2.Fe>Cr >Cu; 猜想3._____。
(查阅资料)
(1)铬是银白色有光泽的金属,在空气中其表面能生成抗腐蚀的致密的氧化膜。
(2)铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液。
(设计与实验)
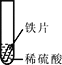
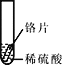
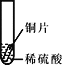
小聪同学取大小相等的三种金属片,用砂纸打磨光亮;再取三支试管,分别放入等量的同种稀硫酸。
实验 | 试管1 | 试管2 | 试管3 |
实验 操作 |
|
|
|
实验 现象 | 铁片表面产生气泡较慢,溶液变为浅绿色 | 铬片表面产生气泡较快,溶液变成为蓝色 | _____。 |
(结论与解释)
小聪得到的结论是猜想_____正确。
(知识运用)
(1)将铬片投入FeSO4溶液中,反应_____(填“能”或“不能”)进行。若能进行,请你写出反应的化学方程式_____。
(2)小明同学只选了三种药品进行实验,也得出了三种金属的活动性顺序,则他选用的三种药品可能是_____。
【答案】Fe>Cu>Cr 无明显变化 1 能 Cr+FeSO4=CrSO4+Fe CrSO4溶液、铁片、CuSO4溶液
【解析】
[作出猜想]铬可能比铁活泼,也可能不如铜活泼,也可能介于铁和铜之间;
[设计与实验]铁片表面产生气泡较慢,铬片表面产生气泡较快,说明铬比铁活泼;铜不能和稀硫酸反应,所以铜片表面不产生气泡;
[结论与解释]由分析可知,猜想1正确;
[知识运用](1)因为铬比铁活泼,所以铬能和硫酸亚铁反应,化学方程式为:Cr+FeSO4═CrSO4+Fe;
(2)证明金属活动性顺序比较简便的方法是:把金属活动性介于中间的金属放入到前后两种金属的盐溶液中或把前后两种金属放入到中间金属的盐溶液中,可用CrSO4溶液、铁片、CuSO4溶液进行验证。

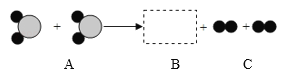
【题目】把A、B、C三种纯净物放在一密闭的容器中,在一定条件下充分反应,反应前后各物质的质量如下表:
物质 | A | B | C |
反应前质量/g | 10 | 2 | 6.2 |
反应后质量/g | 2 | X | 0 |
(1)上表中X的值为_____。
(2)容器中发生的反应属于_____(选填:化合或分解)反应。
(3)若A的相对分子质量为32,B的相对分子质量为142,则该反应的化学方程式中A与B的化学计量数之比为_____。