题目内容
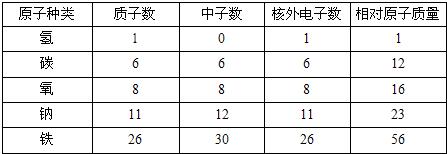
14、已知每个电子的质量约为每个质子(或中子)质量的1/1836,通过下表,可以总结出“在原子里,质子数等于电子数”.

通过此表,可以总结出的规律有:
(1)

通过此表,可以总结出的规律有:
(1)
核内质子数等于核外电子数
;(2)有的原子的核内没有中子
;(3)相对原子质量=质子数+中子数
;(4)质子数不一定等于中子数
.分析:根据图表中的各个数据进行观察和推理.
解答:解:通过观察很明显的两点是质子数等于中子数;氢原子核内没有中子即说明了有的原子核内没有中子;通过观察质子数与中子数之和正好等于相对原子质量,通过观察还能看到质子数与中子数,有的相等,有的不相等.
故答案为:
(1)核内质子数等于核外电子数;
(2)有的原子的核内没有中子;
(3)相对原子质量=质子数+中子数;
(4)质子数不一定等于中子数.
故答案为:
(1)核内质子数等于核外电子数;
(2)有的原子的核内没有中子;
(3)相对原子质量=质子数+中子数;
(4)质子数不一定等于中子数.
点评:要学会通过观察图表来寻找规律的方法,看数值有何关系,横着看,竖着看寻找规律.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
已知每个电子的质量约为每个质子(或中子)质量的
,所以科学上在计算原子的质量时,只计算质子和中子的质量,电子的质量忽略不计.下表是部分原子的构成指数.
观察此表,可总结出“在原子里质子数等于核外电子数”,你还能总结出:
(1) ;
(2) ;
(3) .
| 1 |
| 1836 |
| 原子种类 | 质子数 | 中子数 | 电子数 | 相对原子质量 |
| 氢 | 1 | 0 | 1 | 1 |
| 碳 | 6 | 6 | 6 | 12 |
| 氧 | 8 | 8 | 8 | 16 |
| 钠 | 11 | 12 | 11 | 23 |
| 铁 | 26 | 30 | 26 | 56 |
| 铀 | 92 | 146 | 92 | 238 |
(1)
(2)
(3)