题目内容
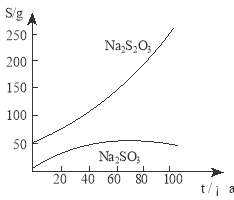
【题目】(5分)Na2S2O3·5H2O 俗称“大苏打”、“海波”,是照相业常用的一种定影剂。它是无色易溶于水的晶体,不溶于乙醇,Na2S2O3·5H2O在40~45℃熔化,48℃分解。硫磺为淡黄色粉末,不溶于水,可溶于乙醇。下图是有关物质的溶解度曲线:
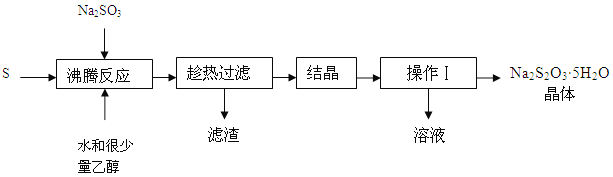
已知:Na2SO3 + S ![]() Na2S2O3 ,用Na2SO3和过量的S制备Na2S2O3·5H2O的实验流程如下:
Na2S2O3 ,用Na2SO3和过量的S制备Na2S2O3·5H2O的实验流程如下:
(1)Na2S2O3中S的化合价为 ;
(2)操作Ⅰ是 ;
(3)趁热过滤的原因是 ;
(4)结晶的方法是 ;
(5)洗涤操作Ⅰ后得到的晶体,可采用的洗涤液是 (从下列选项中选出)。
A.无水乙醇 B.饱和NaCl溶液 C.水
【答案】(1)+2;
(2)过滤;
(3)防止温度降低而使Na2S2O3晶体析出;
(4)降温结晶;
(5)A
【解析】
试题分析:(1)、根据“在化合物中,正负化合价的代数和为零”的原则,已知钠的化合价为+1价,O的化合价为-2价,设硫的化合价为x,则(+1)×2+2x+(-2)×3=0,解得x=+2;
(2)通过操作1将固体和液体分离了,那么操作1是过滤;
(3)根据Na2S2O3的溶解度曲线可知,在温度较低的时候它的溶解度较小,故趁热过滤的目的是防止温度降低而使Na2S2O3晶体析出 ;
(4)Na2S2O3的溶解度随温度的变化变化较大,故可采用降温结晶的方法;
(5)根据资料:Na2S2O3·5H2O它是无色易溶于水的晶体,不溶于乙醇,故可利用无水乙醇来洗涤,选A。

 阅读快车系列答案
阅读快车系列答案【题目】(10分)在化学实验室,某小组同学实验时发现一瓶没有密封好的NaOH已经结块。于是对其成分进行科学探究,请你一起完成探究的过程。
Ⅰ固体的成分分析
【提出问题】结块后的固体成分是什么?
【猜想与假设】
猜想一:固体为碳酸钠
猜想二:固体为碳酸钠和氢氧化钠。
用化学方程式表示固体中有碳酸钠的原因_____________________________________。
【查阅资料】BaCl2溶液pH=7
【实验探究】从瓶中取出一定量的固体,加入足量水溶解,再将溶液分三等份分别装入A、B、C三支试管,进行如图所示实验。
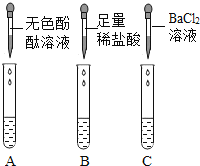
甲同学根据实验现象,认为结块固体中有碳酸钠和氢氧化钠。
【实验分析】
(1)根据甲同学的实验结论可知,三支试管中观察到的实验现象分别为:A试管中________________,B试管出现大量气泡,C试管中出现白色沉淀;
C试管中现象产生的原因是(用化学方程式表示)___________________________。
(2)乙同学认为甲同学的结论是不正确的,原因是_______________________________。
【实验设计】请你设计合理的实验方案,填入下列表格中。
操作 | 现象 | 结论 |
取少量结块固体于试管(或烧杯)中,加水使其完全溶解,__________________ ______________________ _____________________ | _______________________ | 固体为碳酸钠和氢氧化钠 |
Ⅱ固体中各成分含量
为确定该固体样品中Na2CO3的质量分数,小芳同学称取2 g样品,利用A为Y形管、B为量气管、C为水准管作为主要反应容器,进行了如图(I)所示实验。
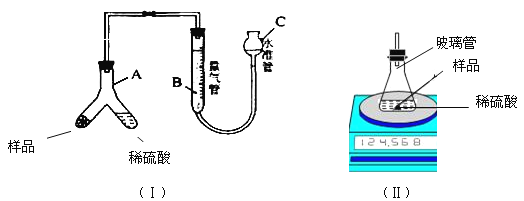
(1)在量气管内水面上架一薄层油,目的是__________________________。
(2)使样品与稀硫酸反应的操作为 __________________________________。
(3)实验结束后,小芳同学读出量气管中的气体体积为22.4ml(已知该温度压强下,CO2的密度为1.965 g/L),请你计算出样品中Na2CO3质量分数。(写出计算过程)
(4)小明同学设计如图(Ⅱ)装置,分别测定反应前、反应后仪器以及仪器内物质的总质量,进行有关计算,实验操作中没有失误,多次测量的结果均偏大,你认为可能的原因是________________________。
【题目】下列对一些事实的解释不正确的是
事实 | 解释 | |
A | 墙内开花墙外香 | 分子在不断地运动 |
B | H2O2能杀菌消毒,而H2O不能 | 两种物质的分子构成不同 |
C | 温度计中的水银热胀冷缩 | 原子的大小发生改变 |
D | 湿衣服在阳光下易晾干 | 受热时分子运动速率加快 |