题目内容
某变质的NaOH固体中含有Na2CO3.老师安排第一小组做除去NaOH溶液中Na2CO3的实验.第二小组同学做测定该固体混合物中Na2CO3质量分数的实验.
Ⅰ、第一小组的同学取一定量的该固体溶于水,得到混合溶液,为了除去溶液中的Na2CO3杂质,甲、乙、丙、丁四位同学分别选择下列试剂进行实验.其中合理的是________.
甲:适量稀盐酸 乙:过量KOH溶液
丙:适量Ca(OH)2溶液 丁:适量CaCl2溶液.
Ⅱ、第二小组利用左下图装置测定NaOH和Na2CO3的混合物中Na2CO3的质量分数,用电子天平称量数据如下表:(相关相对原子质量:C:12 O:16 Na:23 )

| 称量质量 | 质量(g) |
| NaOH和Na2CO3的混合物 | 9.30 |
| 锥形瓶+稀盐酸质量(过量) | 141.20 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物 (反应开始后15秒) | 148.50 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物 (反应开始后35秒) | 148.30 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物 (反应开始后55秒) | 148.30 |
丙 57%
分析:Ⅰ、依据除去杂质需满足的原则:所用试剂只与杂质反应,不可与提纯物反应;反应后不能生产新杂质.依次代入各个选项进行对照分析后,确定答案;
Ⅱ、依据题目中的数据,首先分析出反应前物质的总质量及反应后物质的总质量,再结合质量守恒定律,计算出产生的气体二氧化碳的质量,再由化学方程式算得碳酸钠的质量,最后得出混合物中碳酸钠的质量分数.
解答:Ⅰ、甲选项加入适量稀盐酸,盐酸既与氢氧化钠反应,又与碳酸钠反应,最后得不到纯净的氢氧化钠,故甲错;
乙选项加入过量KOH溶液,根据复分解反应发生的条件,氢氧化钾与氢氧化钠及碳酸钠均不发生反应,故乙错;
丙选项加入适量Ca(OH)2溶液,氢氧化钙与氢氧化钠不反应,与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,过滤即可除去沉淀,故丙对;
丁选项加入适量CaCl2溶液,氯化钙与氢氧化钠不反应,与碳酸钠反应生成碳酸钙沉淀和氯化钠,氯化钠又成为新杂质,故丁错.
故答案为:丙;
Ⅱ、由题目中的数据,得出反应前物质的总质量为:9.30g+141.20g=150.50g,由35秒与55秒的质量相等可得反应后物质的总质量为:148.30g,根据质量守恒定律,可得产生的气体二氧化碳的质量为:150.50g-148.30g=2.20g,
设混合物中碳酸钠的质量为x,
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 2.2g
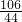 =
=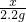 ,
,
解得x=5.3g
碳酸钠的质量分数为: ×100%=57%
×100%=57%
故答案为:57%
点评:该题考查的为除杂题与纯度计算,解题时应明确除杂的两条原则,对题目中的数据仔细分析,梳理出有用数据,由已知向所求依次推导.
分析:Ⅰ、依据除去杂质需满足的原则:所用试剂只与杂质反应,不可与提纯物反应;反应后不能生产新杂质.依次代入各个选项进行对照分析后,确定答案;
Ⅱ、依据题目中的数据,首先分析出反应前物质的总质量及反应后物质的总质量,再结合质量守恒定律,计算出产生的气体二氧化碳的质量,再由化学方程式算得碳酸钠的质量,最后得出混合物中碳酸钠的质量分数.
解答:Ⅰ、甲选项加入适量稀盐酸,盐酸既与氢氧化钠反应,又与碳酸钠反应,最后得不到纯净的氢氧化钠,故甲错;
乙选项加入过量KOH溶液,根据复分解反应发生的条件,氢氧化钾与氢氧化钠及碳酸钠均不发生反应,故乙错;
丙选项加入适量Ca(OH)2溶液,氢氧化钙与氢氧化钠不反应,与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,过滤即可除去沉淀,故丙对;
丁选项加入适量CaCl2溶液,氯化钙与氢氧化钠不反应,与碳酸钠反应生成碳酸钙沉淀和氯化钠,氯化钠又成为新杂质,故丁错.
故答案为:丙;
Ⅱ、由题目中的数据,得出反应前物质的总质量为:9.30g+141.20g=150.50g,由35秒与55秒的质量相等可得反应后物质的总质量为:148.30g,根据质量守恒定律,可得产生的气体二氧化碳的质量为:150.50g-148.30g=2.20g,
设混合物中碳酸钠的质量为x,
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 2.2g
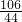 =
=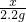 ,
,解得x=5.3g
碳酸钠的质量分数为:
 ×100%=57%
×100%=57%故答案为:57%
点评:该题考查的为除杂题与纯度计算,解题时应明确除杂的两条原则,对题目中的数据仔细分析,梳理出有用数据,由已知向所求依次推导.

练习册系列答案
 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
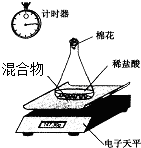 某变质的NaOH固体中含有Na2CO3.老师安排第一小组做除去NaOH溶液中Na2CO3的实验.第二小组同学做测定该固体混合物中Na2CO3质量分数的实验.
某变质的NaOH固体中含有Na2CO3.老师安排第一小组做除去NaOH溶液中Na2CO3的实验.第二小组同学做测定该固体混合物中Na2CO3质量分数的实验.Ⅰ、第一小组的同学取一定量的该固体溶于水,得到混合溶液,为了除去溶液中的Na2CO3杂质,甲、乙、丙、丁四位同学分别选择下列试剂进行实验.其中合理的是
甲:适量稀盐酸乙:过量KOH溶液丙:适量Ca(OH)2溶液丁:适量CaCl2溶液.
Ⅱ、第二小组利用电子天平测定NaOH和Na2CO3的混合物中Na2CO3的质量分数(装置见下图,不考虑水与氯化氢的挥发),实验数据如表:
| 称 量 项 目 | 质量(g) |
| NaOH和Na2CO3的混合物 | 10.00 |
| 锥形瓶+稀盐酸质量(过量) | 141.20 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物(反应开始后15秒) | 149.20 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物(反应开始后35秒) | 149.00 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物(反应开始后55秒) | 149.00 |
(2)试通过分析计算出混合物中Na2CO3的质量分数为多少.
某变质的NaOH固体中含有Na2CO3.老师安排第一小组做除去NaOH溶液中Na2CO3的实验.第二小组同学做测定该固体混合物中Na2CO3质量分数的实验.
Ⅰ、第一小组的同学取一定量的该固体溶于水,得到混合溶液,为了除去溶液中的Na2CO3杂质,甲、乙、丙、丁四位同学分别选择下列试剂进行实验.其中合理的是 .
甲:适量稀盐酸 乙:过量KOH溶液
丙:适量Ca(OH)2溶液 丁:适量CaCl2溶液.
Ⅱ、第二小组利用左下图装置测定NaOH和Na2CO3的混合物中Na2CO3的质量分数,用电子天平称量数据如下表:(相关相对原子质量:C:12 O:16 Na:23 )
则混合物中Na2CO3的质量分数为 .
Ⅰ、第一小组的同学取一定量的该固体溶于水,得到混合溶液,为了除去溶液中的Na2CO3杂质,甲、乙、丙、丁四位同学分别选择下列试剂进行实验.其中合理的是
甲:适量稀盐酸 乙:过量KOH溶液
丙:适量Ca(OH)2溶液 丁:适量CaCl2溶液.
Ⅱ、第二小组利用左下图装置测定NaOH和Na2CO3的混合物中Na2CO3的质量分数,用电子天平称量数据如下表:(相关相对原子质量:C:12 O:16 Na:23 )

| 称量质量 | 质量(g) |
| NaOH和Na2CO3的混合物 | 9.30 |
| 锥形瓶+稀盐酸质量(过量) | 141.20 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物 (反应开始后15秒) |
148.50 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物 (反应开始后35秒) |
148.30 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物 (反应开始后55秒) |
148.30 |
某变质的NaOH固体中含有Na2CO3.老师安排第一小组做除去NaOH溶液中Na2CO3的实验.第二小组同学做测定该固体混合物中Na2CO3质量分数的实验.
Ⅰ、第一小组的同学取一定量的该固体溶于水,得到混合溶液,为了除去溶液中的Na2CO3杂质,甲、乙、丙、丁四位同学分别选择下列试剂进行实验.其中合理的是 .
甲:适量稀盐酸乙:过量KOH溶液丙:适量Ca(OH)2溶液丁:适量CaCl2溶液.
Ⅱ、第二小组利用电子天平测定NaOH和Na2CO3的混合物中Na2CO3的质量分数(装置如图,不考虑水与氯化氢的挥发),实验数据如表:
(1)写出固体混合物与盐酸发生化学反应的化学方程式: .
(2)试通过分析计算出混合物中Na2CO3的质量分数为多少?
答: .

| 称量项目 | 质量(g) |
| NaOH和Na2CO3的混合物 | 10.00 |
| 锥形瓶+稀盐酸质量(过量) | 141.20 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物(反应开始后15秒) | 149.20 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物(反应开始后35秒) | 149.00 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物(反应开始后55秒) | 149.00 |
甲:适量稀盐酸乙:过量KOH溶液丙:适量Ca(OH)2溶液丁:适量CaCl2溶液.
Ⅱ、第二小组利用电子天平测定NaOH和Na2CO3的混合物中Na2CO3的质量分数(装置如图,不考虑水与氯化氢的挥发),实验数据如表:
(1)写出固体混合物与盐酸发生化学反应的化学方程式:
(2)试通过分析计算出混合物中Na2CO3的质量分数为多少?
答:
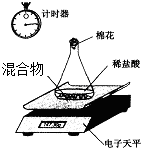 某变质的NaOH固体中含有Na2CO3.老师安排第一小组做除去NaOH溶液中Na2CO3的实验.第二小组同学做测定该固体混合物中Na2CO3质量分数的实验.
某变质的NaOH固体中含有Na2CO3.老师安排第一小组做除去NaOH溶液中Na2CO3的实验.第二小组同学做测定该固体混合物中Na2CO3质量分数的实验.
Ⅰ、第一小组的同学取一定量的该固体溶于水,得到混合溶液,为了除去溶液中的Na2CO3杂质,甲、乙、丙、丁四位同学分别选择下列试剂进行实验.其中合理的是________.
甲:适量稀盐酸乙:过量KOH溶液丙:适量Ca(OH)2溶液丁:适量CaCl2溶液.
Ⅱ、第二小组利用电子天平测定NaOH和Na2CO3的混合物中Na2CO3的质量分数(装置见下图,不考虑水与氯化氢的挥发),实验数据如表:
| 称 量 项 目 | 质量(g) |
| NaOH和Na2CO3的混合物 | 10.00 |
| 锥形瓶+稀盐酸质量(过量) | 141.20 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物(反应开始后15秒) | 149.20 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物(反应开始后35秒) | 149.00 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物(反应开始后55秒) | 149.00 |
(2)试通过分析计算出混合物中Na2CO3的质量分数为多少.
某变质的NaOH固体中含有Na2CO3.老师安排第一小组做除去NaOH溶液中Na2CO3的实验.第二小组同学做测定该固体混合物中Na2CO3质量分数的实验.
Ⅰ、第一小组的同学取一定量的该固体溶于水,得到混合溶液,为了除去溶液中的Na2CO3杂质,甲、乙、丙、丁四位同学分别选择下列试剂进行实验.其中合理的是 .
甲:适量稀盐酸乙:过量KOH溶液丙:适量Ca(OH)2溶液丁:适量CaCl2溶液.
Ⅱ、第二小组利用电子天平测定NaOH和Na2CO3的混合物中Na2CO3的质量分数(装置如图,不考虑水与氯化氢的挥发),实验数据如表:
(1)写出固体混合物与盐酸发生化学反应的化学方程式: .
(2)试通过分析计算出混合物中Na2CO3的质量分数为多少?
答: .
| 称量项目 | 质量(g) |
| NaOH和Na2CO3的混合物 | 10.00 |
| 锥形瓶+稀盐酸质量(过量) | 141.20 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物(反应开始后15秒) | 149.20 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物(反应开始后35秒) | 149.00 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物(反应开始后55秒) | 149.00 |
甲:适量稀盐酸乙:过量KOH溶液丙:适量Ca(OH)2溶液丁:适量CaCl2溶液.
Ⅱ、第二小组利用电子天平测定NaOH和Na2CO3的混合物中Na2CO3的质量分数(装置如图,不考虑水与氯化氢的挥发),实验数据如表:
(1)写出固体混合物与盐酸发生化学反应的化学方程式: .
(2)试通过分析计算出混合物中Na2CO3的质量分数为多少?
答: .
