题目内容
【题目】不能正确反映对应变化关系的图像是( )
A.在一定量的CuSO4溶液中逐滴加入NaOH溶液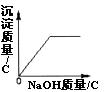
B.等质量的Zn和Mg分别与足量等体积等质量分数的稀硫酸反应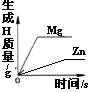
C.向NaOH溶液中逐滴加入稀盐酸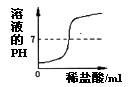
D.等质量CaCO3分别与足量等体积等质量分数的稀盐酸反应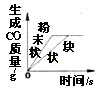
【答案】C
【解析】A. 在一定量的CuSO4溶液中逐滴加入NaOH溶液,两者之间反应生成氢氧化铜沉淀和硫酸钠,A不符合题意;
B. 镁的活动性比锌的强,所以镁先反应完;等质量的Zn和Mg分别与足量等体积等质量分数的稀硫酸反应,镁比锌生成氢气多,B不符合题意;
C. 氢氧化钠溶液呈碱性,pH大于7,盐酸溶液的pH小于7,向NaOH溶液中逐滴加入稀盐酸,溶液的pH应逐渐减小,C符合题意;
D. 等质量CaCO3分别与足量等体积等质量分数的稀盐酸反应,通常粉末状时,药品和盐酸接触更充分,反应较快;当块状石灰石反应时,速率较慢;但过氧化氢质量相同时,生成物的质量相同,D不符合题意。
所以答案是:C。
【考点精析】根据题目的已知条件,利用金属材料的选择依据的相关知识可以得到问题的答案,需要掌握黑色金属:通常指铁、锰、铬及它们的合金.重金属:如铜、锌、铅等;有色金属轻金属:如钠、镁、铝等;有色金属:通常是指除黑色金属以外的其他金属.

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案【题目】工业上采用氨碱法生产纯碱,主要流程如下图,请据图回答相关问题。![]()
(1)氨碱法生产所得产品为纯碱,向纯碱水溶液中滴入无色酚酞试液显色。
(2)从步骤①提取粗盐常用(填“蒸发结晶”或“降温结晶”)方法。
(3)从酸碱反应的角度分析,步骤④中通入氨气的作用是。
(4)步骤⑤所得的碳酸氢钠在生产和生活中有许多重要用途,请写出它的一种用途。
(5)步骤⑥中发生反应的化学方程式为 , 该反应类型属于反应。
(6)工业产品中往往含有一些杂质,用“氨碱法”制得的纯碱含有少量氯化钠。为了测定该产品中碳酸钠的纯度,进行以下实验:取16.5g纯碱样品放入烧杯中,将烧杯放在电子天平上,再把150g稀盐酸(足量)加入样品中,观察读数变化如下表所示:
时间/s | 0 | 5 | 10 | 15 |
读数/g | 215.2 | 211.4 | 208.6 | 208.6 |
请你据此分析计算:
①实验中产生二氧化碳的质量为;
②该产品中碳酸钠的质量分数 (写出计算过程,结果精确到0.1%)