题目内容
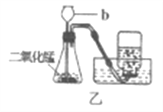
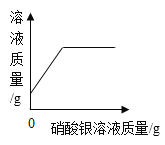
【题目】某小组用粗锌测定某稀硫酸中溶质的质量分数。取一定质量的稀硫酸于烧杯中,称量稀硫酸和烧杯的总质量;然后,向其中分两次加入粗锌(杂质不参加反应),实验过程和数据如图所示。请计算:
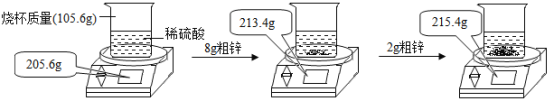
(1)生成氢气的总质量为 g。
(2)稀硫酸中溶质的质量分数。
【答案】(1)0.2g;(2)9.8%
【解析】
(1)由图可知,先加入8g粗锌,反应后,天平显示的质量是213.4g,再加入2g粗锌,天平显示的质量是215.4g,故第一次加入8g粗锌,已经完全反应。生成氢气的总质量为:205.6g+8g-213.4g=0.2g;
(2)解:设稀硫酸中溶质的质量分数为x
加入稀硫酸的质量为:205.6g-105.6g=100g;
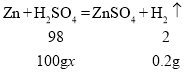
![]()
x=9.8%
答:稀硫酸中溶质的质量分数为9.8%。

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案【题目】某班同学用氢氧化钠溶液和稀硫酸进行中和反应实验:
(1)甲同学在烧杯中加入约5mL氢氧化钠溶液,滴入几滴无色酚酞溶液,此时溶液呈_____色,接着用滴管滴入一定量的稀硫酸,再用玻璃棒搅拌,发现溶液变为无色,该反应的化学方程式为_____
(2)甲、乙、丙同学对反应后溶液中的溶质成分进行探究。
(猜想与假设)反应后溶液中的溶质是什么?
猜想一:只有Na2SO4;
猜想二:_____
猜想三:可能是Na2SO4和NaOH
以上猜想中,可以直接排除的是_____,理由_____。
(实验探究)
为了验证另外两种猜想,甲、乙、丙同学设计如下实验方案:
实验操作 | 实验现象 | 实验结论 | |
甲同学方案 | 取少量反应后的溶液于试管中,向试管中滴加BaCl2溶液, | 有白色沉淀产生。 | 猜想二成立 |
乙同学方案 | 取少量反应后的溶液于试管中,向试管中加入_____ | 有气泡产生。 | 猜想二成立 |
丙同学方案 | 取少量反应后的溶液于试管中,向试管中加入生锈的铁钉。 | _____ | 猜想二成立 |
老师认为甲同学方案不合理,你认为理由是_____。
(反思交流)实验结束后,废液处理方法正确的是_____(填序号)。
A 倒入下水道 B 倒入废液缸