题目内容
【题目】某兴趣小组对实验室制备氧气的反应条件进行如下探究实验.
(1)为探究不同催化剂对氯酸钾分解速度的影响,甲设计以下对比实验探究,在相同温度下,比较两组实验产生O2的快慢.
Ⅰ.将3.0g KClO3与1.0g MnO2均匀混合加热
Ⅱ.将x g KClO3与1.0g CuO均匀混合加热
实验中Ⅱ中x的值应为 ;Ⅰ中反应的化学方程式是 。
实验结论:在其他条件相同的情况下,MnO2的催化能力比CuO强。
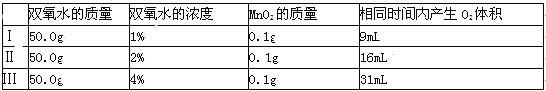
(2)乙探究了影响双氧水分解速度的某种因素.实验数据记录和可选装置如下:
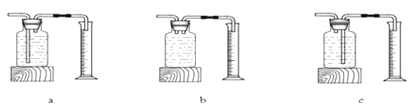
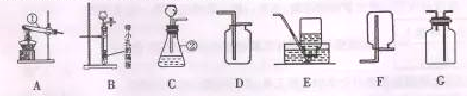
本实验中,测量O2体积的装置应该是 (填编号);
实验结论:乙探究中,在其他条件相同的情况下, ,双氧水分解得越快。
【答案】(1)3.0克,2KClO3![]() 2KCl+3O2↑(2)C,双氧水的浓度越大。
2KCl+3O2↑(2)C,双氧水的浓度越大。
【解析】
试题分析:实验中Ⅱ中x的值应为3.0克,因为目的是控制相同的变量;Ⅰ中反应的化学方程式是2KClO3![]() 2KCl+3O2↑;本实验中,测量O2体积的装置应该是C,;从实验结论看:乙探究中,在其他条件相同的情况下,双氧水的浓度越大,双氧水分解得越快。
2KCl+3O2↑;本实验中,测量O2体积的装置应该是C,;从实验结论看:乙探究中,在其他条件相同的情况下,双氧水的浓度越大,双氧水分解得越快。

练习册系列答案
相关题目