题目内容
碳酸钙、碳酸氢铵、碱式碳酸铜是常见的三种碳酸盐.小敏和小芳准备研究一下三种碳酸盐的部分性质,请你跟着她们一起来探究:
【查阅资料】碳酸钙:白色粉末,20℃溶解度为0.0065g,水溶液的pH 值为9.5~10.2,空气饱和碳酸钙水溶液的pH 值为8.0~8.6;
碱式碳酸铜:绿色粉末状固体,俗称铜绿;20℃溶解度为0.0008g,其水溶液pH值约为7;
碳酸氢铵:白色粉状固体,溶解度受温度影响较大,20℃时溶解度为21.7g,溶液pH值约为8.
【猜想一】三种碳酸盐是否都能使酚酞变色,不同温度下变色情况是否不同?
【设计方案】
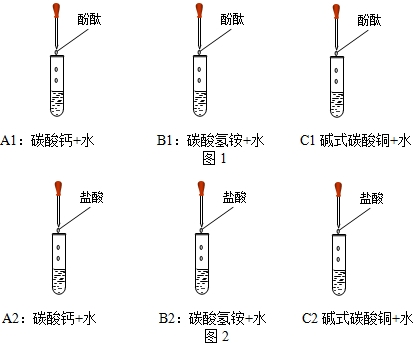
(1)小敏在三个试管中分别加入碳酸钙、碳酸氢铵、碱式碳酸铜,然后分别加入蒸馏水,振荡,滴加酚酞(如图1所示),发现A1试管内变红,B1试管内淡红色,C1试管内不红,说明碳酸钙水溶液的碱性______碳酸氢铵水溶液的碱性(填“大于”、“小于”或“等于”);
(2)小芳也做同样的实验,她在试管内加入铜绿,再加蒸馏水,发现试管内马上变红,请你帮她分析原因可能是______.
(3)小敏继续把上述三个试管放入装有80℃热水的烧杯中,(如图1)发现B1试管内产生密集的气泡,并闻到______,溶液红色加深;写出反应的方程式______.水浴加热后碳酸氢铵碱性加强说明氨气在水中的溶解性______二氧化碳(填“大于”或“小于”或“等于”).
(4)小芳另取一定量的碳酸氢铵固体,放置在小烧杯中,用开水直接浇注在烧杯中,观察到烧杯中迅速产生大量的气泡并且连液体一起溢出烧杯.碳酸氢铵开水浇注比水浴加热反应更快的原因是:______.
【猜想二】三种碳酸盐是否都能与盐酸反应?
【设计方案】
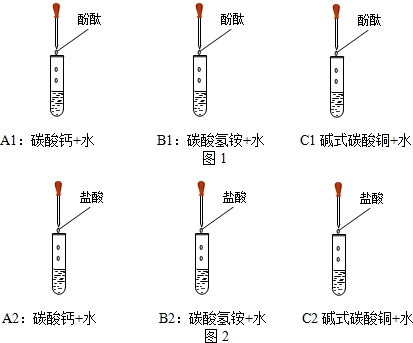
(1)小敏另取三个试管,分别加入少量碳酸钙、碳酸氢铵、碱式碳酸铜,用胶头滴管逐滴滴加稀盐酸,(如图2所示)发现三种物质都能和稀盐酸反应.试管C2中现象为______,判断铜绿过量的标志是______;B2中试管外壁温度______(填“上升”、“下降”或“不变”);写出C2中的反应方程式______.
【反思与评价】三种碳酸盐都能与盐酸反应,但并不都能使酚酞变红.
解:(1)碱能使酚酞试液变红色,由A1试管内变红,B1试管内淡红色,可知A1试管内物质比B1试管内物质碱性强;
(2)绿色粉末状固体的水溶液pH值约为7,不能使酚酞试液变红,所以是铜绿中可能混有碱性物质才能导致变红;
(3)碳酸氢铵受热易分解出氨气,氨气是一种有刺激性气味的气体;反应的方程式为:NH4HCO3 NH3↑+CO2↑+H2O;氨气的水溶液显碱性,能使酚酞试液变成红色,虽然二氧化碳的水溶液显酸性,应该不能使酚酞试液变色,但根据最终的现象是酚酞试液变成了红色,说明溶液最终表现为碱性,是由于氨气在水中的溶解性大于二氧化碳的缘故;
NH3↑+CO2↑+H2O;氨气的水溶液显碱性,能使酚酞试液变成红色,虽然二氧化碳的水溶液显酸性,应该不能使酚酞试液变色,但根据最终的现象是酚酞试液变成了红色,说明溶液最终表现为碱性,是由于氨气在水中的溶解性大于二氧化碳的缘故;
(4)水浴法加热的特点是受热比较均匀,但速度较慢,而开水浇注法是将开水与碳酸氢铵固体直接接触,能够使其温度迅速升高而分解,从微观的角度看是由于温度越高,微粒碰撞的几率越大,所以反应速度该更快.
【设计方案】(1)碱式碳酸铜与盐酸反应生成氯化铜、水、二氧化碳,所以现象是有气泡产生,溶液由无色变为蓝色;铜绿20℃溶解度为0.0008g,所以常温下几乎不溶解,所以铜绿过量会沉积在试管底部;碳酸氢铵与盐酸反应放出热量,所以会使溶液温度升高;碱式碳酸铜与盐酸反应的反应物是碱式碳酸铜和盐酸,生成物是氯化铜、水、二氧化碳,用观察法配平,二氧化碳后面标上上升符号.
故答案为:(1)大于;(2)铜绿中可能混有碱性物质;(3)刺激性; NH4HCO3 NH3↑+CO2↑+H2O;大于;(4)用热水浇注温度上升的快,微粒的碰撞几率大;【设计方案】(1)有气泡产生,溶液由无色变为蓝色;试管底部有绿色粉末状固体;上升;Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2↑.
NH3↑+CO2↑+H2O;大于;(4)用热水浇注温度上升的快,微粒的碰撞几率大;【设计方案】(1)有气泡产生,溶液由无色变为蓝色;试管底部有绿色粉末状固体;上升;Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2↑.
分析:(1)由A1试管内变红,B1试管内淡红色考虑碱性强弱;(2)根据碱式碳酸铜的酸碱性考虑;(3)根据碳酸氢铵受热易分解,氨气的水溶液显碱性回答;根据氨气的水溶液显碱性,二氧化碳的水溶液显酸性,但最终的现象是酚酞变红来分析;(4)对比水浴法加热和浇注法加热的快慢程度分析;【设计方案】(1)根据碱式碳酸铜与盐酸反应的生成物考虑现象;根据铜绿20℃溶解度为0.0008g考虑剩余时的现象;根据反应时放热还是吸热考虑温度的升高还是降低,根据方程式的写法写出方程式.
点评:解答本题关键是要知道碱能使无色酚酞试液变红色,氨气具有刺激性气味,知道根据方程式中的生成物来描述实验现象的方法,熟悉方程式的书写方法.
(2)绿色粉末状固体的水溶液pH值约为7,不能使酚酞试液变红,所以是铜绿中可能混有碱性物质才能导致变红;
(3)碳酸氢铵受热易分解出氨气,氨气是一种有刺激性气味的气体;反应的方程式为:NH4HCO3
 NH3↑+CO2↑+H2O;氨气的水溶液显碱性,能使酚酞试液变成红色,虽然二氧化碳的水溶液显酸性,应该不能使酚酞试液变色,但根据最终的现象是酚酞试液变成了红色,说明溶液最终表现为碱性,是由于氨气在水中的溶解性大于二氧化碳的缘故;
NH3↑+CO2↑+H2O;氨气的水溶液显碱性,能使酚酞试液变成红色,虽然二氧化碳的水溶液显酸性,应该不能使酚酞试液变色,但根据最终的现象是酚酞试液变成了红色,说明溶液最终表现为碱性,是由于氨气在水中的溶解性大于二氧化碳的缘故;(4)水浴法加热的特点是受热比较均匀,但速度较慢,而开水浇注法是将开水与碳酸氢铵固体直接接触,能够使其温度迅速升高而分解,从微观的角度看是由于温度越高,微粒碰撞的几率越大,所以反应速度该更快.
【设计方案】(1)碱式碳酸铜与盐酸反应生成氯化铜、水、二氧化碳,所以现象是有气泡产生,溶液由无色变为蓝色;铜绿20℃溶解度为0.0008g,所以常温下几乎不溶解,所以铜绿过量会沉积在试管底部;碳酸氢铵与盐酸反应放出热量,所以会使溶液温度升高;碱式碳酸铜与盐酸反应的反应物是碱式碳酸铜和盐酸,生成物是氯化铜、水、二氧化碳,用观察法配平,二氧化碳后面标上上升符号.
故答案为:(1)大于;(2)铜绿中可能混有碱性物质;(3)刺激性; NH4HCO3
 NH3↑+CO2↑+H2O;大于;(4)用热水浇注温度上升的快,微粒的碰撞几率大;【设计方案】(1)有气泡产生,溶液由无色变为蓝色;试管底部有绿色粉末状固体;上升;Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2↑.
NH3↑+CO2↑+H2O;大于;(4)用热水浇注温度上升的快,微粒的碰撞几率大;【设计方案】(1)有气泡产生,溶液由无色变为蓝色;试管底部有绿色粉末状固体;上升;Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2↑.分析:(1)由A1试管内变红,B1试管内淡红色考虑碱性强弱;(2)根据碱式碳酸铜的酸碱性考虑;(3)根据碳酸氢铵受热易分解,氨气的水溶液显碱性回答;根据氨气的水溶液显碱性,二氧化碳的水溶液显酸性,但最终的现象是酚酞变红来分析;(4)对比水浴法加热和浇注法加热的快慢程度分析;【设计方案】(1)根据碱式碳酸铜与盐酸反应的生成物考虑现象;根据铜绿20℃溶解度为0.0008g考虑剩余时的现象;根据反应时放热还是吸热考虑温度的升高还是降低,根据方程式的写法写出方程式.
点评:解答本题关键是要知道碱能使无色酚酞试液变红色,氨气具有刺激性气味,知道根据方程式中的生成物来描述实验现象的方法,熟悉方程式的书写方法.

练习册系列答案
相关题目