题目内容
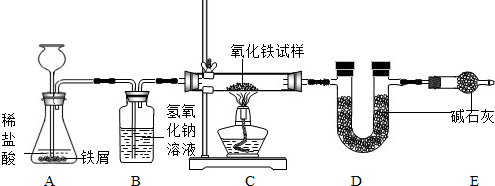
化学活动小组的小江同学为了测定某不纯氧化铁试样中氧化铁的质量分数(其中的杂质不参与反应),设计了如右图所示的实验装置.试回答下列问题:
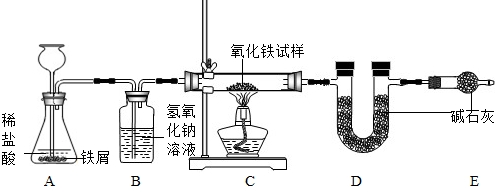
(1)写出装置A、B、C中发生反应的化学方程式:
,
,
.
(2)小江通过称量反应前后D部分的质量,来计算试样中氧化铁的质量分数,若按这一方案进行实验并记录数据,则计算结果与实际值相比会 (填“偏大”、“偏小”或“相同”).
(3)对于小江同学设计的这个实验方案,你有什么改进意见? .

(1)写出装置A、B、C中发生反应的化学方程式:
,
,
.
(2)小江通过称量反应前后D部分的质量,来计算试样中氧化铁的质量分数,若按这一方案进行实验并记录数据,则计算结果与实际值相比会 (填“偏大”、“偏小”或“相同”).
(3)对于小江同学设计的这个实验方案,你有什么改进意见? .
(1)根据盐酸和氢气的性质等,可以推得A、B、C中发生反应的化学方程式是:Fe+2HCl=FeCl2+H2↑,NaOH+HCl=NaCl+H2O,3H2+Fe2O3
2Fe+3H2O.
(2)由于从装置B中导出的氢气会带出的水蒸气,最后也被装置D所吸收,从而导致装置D所增加的质量大于了反应生成的水的质量;所以,用装置D所增加的质量(即将其看作生成的水的质量)来计算试样中氧化铁的质量分数时,算结果与实际值相比会偏大.
(3)为了不让从装置B中导出的氢气会带出的水蒸气,被装置D所吸收而引起误差;可以在装置B、C之间,增添一个气体干燥装置(即盛有浓硫酸的洗气瓶),以便吸收从装置B中导出的氢气会带出的水蒸气,避免造成误差.
故答案为:(1)Fe+2HCl=FeCl2+H2↑,NaOH+HCl=NaCl+H2O,3H2+Fe2O3
2Fe+3H2O.
(2)偏大.
(3)在装置B、C之间,增添一个气体干燥装置(即盛有浓硫酸的洗气瓶).
| ||
(2)由于从装置B中导出的氢气会带出的水蒸气,最后也被装置D所吸收,从而导致装置D所增加的质量大于了反应生成的水的质量;所以,用装置D所增加的质量(即将其看作生成的水的质量)来计算试样中氧化铁的质量分数时,算结果与实际值相比会偏大.
(3)为了不让从装置B中导出的氢气会带出的水蒸气,被装置D所吸收而引起误差;可以在装置B、C之间,增添一个气体干燥装置(即盛有浓硫酸的洗气瓶),以便吸收从装置B中导出的氢气会带出的水蒸气,避免造成误差.
故答案为:(1)Fe+2HCl=FeCl2+H2↑,NaOH+HCl=NaCl+H2O,3H2+Fe2O3
| ||
(2)偏大.
(3)在装置B、C之间,增添一个气体干燥装置(即盛有浓硫酸的洗气瓶).

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目