题目内容
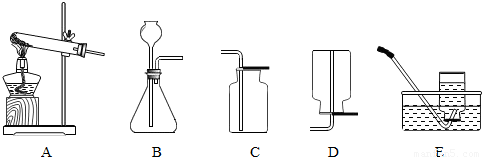
“比较归纳法”是学习化学的主要方法.小明同学在学习O2和CO2的实验室制法后,做了一份笔记,请你帮助他补填表中空格(“气体发生装置”和“气体收集装置”栏选择图示装置的编号填写),并回答后面的问题.

(1)检验二氧化碳的方法是
(2)已知氨气(NH3)是一种无色、有刺激性气味、密度比空气小、极易溶于水的气体.实验室可以用加热氯化铵和消石灰固体混合物的方法制取氨气.请分析:应选择的发生装置是

| 制取 气体 |
反应的化学方程式 | 反应物状态 | 反应条件 | 发生 装置 |
气体物理性质 | 收集 装置 | ||||
| O2 | 2KClO3
|
固体 固体 |
需要加热 | A | 不易溶于水 密度比空气略大 |
C或E | ||||
| H2 | Zn+H2SO4=ZnSO4+H2↑ Zn+H2SO4=ZnSO4+H2↑ |
固体和液体 | 不需加热 | B | 不易溶于水 密度比空气小 |
D或E | ||||
| CO2 | CaCO3+2HCl═CaCl2+H2O+CO2↑ CaCO3+2HCl═CaCl2+H2O+CO2↑ |
固体和液体 | 不需加热 | B B |
能溶于水 密度比空气大 |
C C |
向集气瓶中倒入澄清石灰水,若石灰水变浑浊则是二氧化碳
向集气瓶中倒入澄清石灰水,若石灰水变浑浊则是二氧化碳
,该反应的化学方程式是CO2+Ca(OH)2═CaCO3↓+H2O
CO2+Ca(OH)2═CaCO3↓+H2O
.二氧化碳能使紫色石蕊试液变红
红
色,反应方程式是CO2+H2O═H2CO3
CO2+H2O═H2CO3
.(2)已知氨气(NH3)是一种无色、有刺激性气味、密度比空气小、极易溶于水的气体.实验室可以用加热氯化铵和消石灰固体混合物的方法制取氨气.请分析:应选择的发生装置是
A
A
,可以选用D
D
装置收集氨气.为防止多余的氨气逸出污染空气,可以用生活中常见的一种物质来吸收多余的氨气,这种物质是水
水
.分析:根据实验室制取氧气、氢气、二氧化碳的反应原理书写方程式,依据反应物的状态和反应条件选择发生装置,依据气体的密度和溶解性选择收集装置;
(1)二氧化碳与澄清的石灰水反应生成碳酸钙沉淀,故可用于检验二氧化碳,二氧化碳和水反应生成碳酸,碳酸可使石蕊变红;
(2)依据发生和收集装置的选取方法进行分析,并据氨气的性质进行尾气处理.
(1)二氧化碳与澄清的石灰水反应生成碳酸钙沉淀,故可用于检验二氧化碳,二氧化碳和水反应生成碳酸,碳酸可使石蕊变红;
(2)依据发生和收集装置的选取方法进行分析,并据氨气的性质进行尾气处理.
解答:解:加热氯酸钾、二氧化锰的混合物制取氧气,反应物是固体;实验室制取氢气用锌与稀硫酸反应生成硫酸锌和氢气,方程式是:Zn+H2SO4=ZnSO4+H2↑;实验室制取二氧化碳用大理石和稀盐酸反应,方程式是:CaCO3+2HCl═CaCl2+H2O+CO2↑;该反应不需加热,属于固体和液体常温反应,故选发生装置B,二氧化碳能溶于水,密度比空气大,故只能用向上排空气法收集;
(1)二氧化碳与澄清的石灰水反应生成碳酸钙沉淀,故可用于检验二氧化碳,方程式是:CO2+Ca(OH)2═CaCO3↓+H2O;二氧化碳和水反应生成碳酸,碳酸可使石蕊变红,反应的方程式是:CO2+H2O═H2CO3;
(2)用加热氯化铵和消石灰固体混合物的方法制取氨气,属于固体加热型,故选发生装置A,氨气密度比空气小、极易溶于水,故只能用向下排空气法收集;为防止多余的氨气逸出污染空气,根据氨气极易溶于水的性质,可用水进行吸收;
故答案为:
(1)向集气瓶中倒入澄清石灰水,若石灰水变浑浊则是二氧化碳;CO2+Ca(OH)2═CaCO3↓+H2O;红;CO2+H2O═H2CO3;
(2)A;D;水.
(1)二氧化碳与澄清的石灰水反应生成碳酸钙沉淀,故可用于检验二氧化碳,方程式是:CO2+Ca(OH)2═CaCO3↓+H2O;二氧化碳和水反应生成碳酸,碳酸可使石蕊变红,反应的方程式是:CO2+H2O═H2CO3;
(2)用加热氯化铵和消石灰固体混合物的方法制取氨气,属于固体加热型,故选发生装置A,氨气密度比空气小、极易溶于水,故只能用向下排空气法收集;为防止多余的氨气逸出污染空气,根据氨气极易溶于水的性质,可用水进行吸收;
故答案为:
| 制取 气体 |
反应的化学方程式 | 反应物状态 | 反应条件 | 发生 装置 |
气体物理性质 | 收集 装置 | ||||
| O2 | 2KClO3
|
固体 | 需要加热 | A | 不易溶于水 密度比空气略大 |
C或E | ||||
| H2 | Zn+H2SO4=ZnSO4+H2↑ | 固体和液体 | 不需加热 | B | 不易溶于水 密度比空气小 |
D或E | ||||
| CO2 | CaCO3+2HCl═CaCl2+H2O+CO2↑ | 固体和液体 | 不需加热 | B | 能溶于水 密度比空气大 |
C |
(2)A;D;水.
点评:掌握实验室制取氧气、氢气和二氧化碳的反应原理、装置选取方法、检验、验满、及方程式的书写等知识是解答此类题目的关键.

练习册系列答案
相关题目
“比较归纳法”是学习化学的主要方法.小明同学在学习O2和CO2的实验室制法后,做了一份笔记,请你帮助他补填表中空格(“气体发生装置”和“气体收集装置”栏选择图示装置的编号填写),并回答后面的问题.
(1)检验二氧化碳的方法是 ,该反应的化学方程式是 .二氧化碳能使紫色石蕊试液变 色,反应方程式是 .
(2)已知氨气(NH3)是一种无色、有刺激性气味、密度比空气小、极易溶于水的气体.实验室可以用加热氯化铵和消石灰固体混合物的方法制取氨气.请分析:应选择的发生装置是 ,可以选用 装置收集氨气.为防止多余的氨气逸出污染空气,可以用生活中常见的一种物质来吸收多余的氨气,这种物质是 .

| 制取 气体 | 反应的化学方程式 | 反应物状态 | 反应条件 | 发生 装置 | 气体物理性质 | 收集 装置 |
| O2 | 2KClO3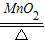 2KCl+3O2↑ 2KCl+3O2↑ | 需要加热 | A | 不易溶于水 密度比空气略大 | C或E | |
| H2 | 固体和液体 | 不需加热 | B | 不易溶于水 密度比空气小 | D或E | |
| CO2 | 固体和液体 | 不需加热 | 能溶于水 密度比空气大 |
(2)已知氨气(NH3)是一种无色、有刺激性气味、密度比空气小、极易溶于水的气体.实验室可以用加热氯化铵和消石灰固体混合物的方法制取氨气.请分析:应选择的发生装置是 ,可以选用 装置收集氨气.为防止多余的氨气逸出污染空气,可以用生活中常见的一种物质来吸收多余的氨气,这种物质是 .