题目内容
【题目】根据如图回答下列问题:
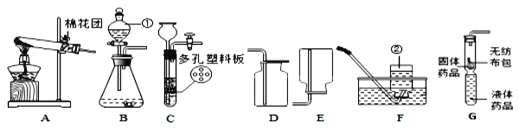
(1)写出图中仪器①的名称______.
(2)实验室准备用氯酸钾制取比较纯净的氧气,采用的装置组合是______,该反应的化学方程式为______。反应类型是______。实验室用高锰酸钾制取氧气,需要对装置B进行的改进是______。试管口略向下倾斜的原因是______。
(3)实验室制取二氧化碳的原料是______(名称),收集装置是_____(填字母).化学方程式为_______。
(4)已知:铁在高温下和水蒸气发生化学反应生成四氧化三铁和另外一种可燃性气体单质,写出该反应的化学方程式______。
(5)氨气是无色、有刺激性气味、极易溶于水的气体,实验室常用加热氯化铵和熟石灰固体混合物的方法制取氨气,则实验室制取并收集氨气的最佳装置组合是_____.(填字母)
(6)小海用如图G装置验证二氧化碳与水的反应,为说明使石蕊变色的物质是碳酸而不是水或二氧化碳,应该采取的实验操作顺序是______(填序号,可重复选用).
①从b端通氮气
②将用石蕊溶液染成紫色的干燥纸花放入广口瓶中
③从a端通二氧化碳
④从分液漏斗中滴加适量水.
【答案】长颈漏斗 BE 2KClO3![]() 2KCl+3O2↑ 分解反应 在试管口塞一团棉花 防止冷凝水回流炸裂试管 大理石(或石灰石)、稀盐酸 D CaCO3+2HCl=CaCl2+CO2↑+H2O 3Fe+4H2O
2KCl+3O2↑ 分解反应 在试管口塞一团棉花 防止冷凝水回流炸裂试管 大理石(或石灰石)、稀盐酸 D CaCO3+2HCl=CaCl2+CO2↑+H2O 3Fe+4H2O![]() Fe3O4+4H2 BF ②③①④③
Fe3O4+4H2 BF ②③①④③
【解析】
(1)仪器①是长颈漏斗,故填:长颈漏斗;
(2)实验室用氯酸钾制取氧气需要加热,应该用B装置作为发生装置;
因为氧气的密度比空气大,可以用向上排空气法收集,即用D装置收集,氧气不易溶于水,可以用排水法收集,即用E装置收集,用排水法收集的氧气比用排空气法收集的氧气纯净;
该反应的化学方程式为:2KClO3![]() 2KCl+3O2↑,该反应的特征是一变多,属于分解反应;实验室用高锰酸钾制取氧气,需要对装置A进行的改进是在试管口塞一团棉花;试管口略向下倾斜的原因是防止冷凝水回流炸裂试管;
2KCl+3O2↑,该反应的特征是一变多,属于分解反应;实验室用高锰酸钾制取氧气,需要对装置A进行的改进是在试管口塞一团棉花;试管口略向下倾斜的原因是防止冷凝水回流炸裂试管;
故填:BE;2KClO3![]() 2KCl+3O2↑;分解反应;在试管口塞一团棉花;防止冷凝水回流炸裂试管。
2KCl+3O2↑;分解反应;在试管口塞一团棉花;防止冷凝水回流炸裂试管。
(3)实验室制取二氧化碳用大理石或石灰石和稀盐酸反应,二氧化碳的密度比空气大且能溶于水,所以用向上排空气法收集,大理石或石灰石的主要成分碳酸钙与盐酸反应生成氯化钙、水、二氧化碳,反应为CaCO3+2HCl=CaCl2+CO2↑+H2O;
故填:大理石(或石灰石)、稀盐酸;D;CaCO3+2HCl=CaCl2+CO2↑+H2O;
(4)根据质量守恒定律可知另一种气体是氢气,铁在高温下和水蒸气发生化学反应生成四氧化三铁和氢气;
故填:3Fe+4H2O![]() Fe3O4+4H2;
Fe3O4+4H2;
(5)用加热氯化铵和熟石灰固体混合物的方法制取氨气,属于固体加热型,故选发生装置B,因为氨气极易溶于水,密度比空气小(相对分子质量17<29),故采用向下排空气法收集,氨气有刺激性气味,所以多余的尾气最好用水吸收,故选装置F收集;
故填:BF;
(6)本题是验证使石蕊变色的物质是碳酸而不是二氧化碳,所以将石蕊溶液染成紫色的干燥纸花放入广口瓶中,从a端通二氧化碳,此时用石蕊溶液染成紫色的干燥纸花不变色;然后再从b端通氮气将广口瓶中的二氧化碳排出,接着从分液漏斗中滴加适量水,纸花仍不变色;最后再从a端通入二氧化碳,此时被水润湿的纸花变红;
故填:②③①④③。

【题目】为测定某黄铜(铜、锌合金)中铜的质量分数,称取32.5g该黄铜粉末放入烧杯中,再向烧杯内加入200g稀硫酸(足量),每隔10分钟测烧杯内(不含烧杯)剩余物质的质量,测得数据如表:
加入稀硫酸后10分钟 | 加入稀硫酸后20分钟 | 加入稀硫酸后 | 加入稀硫酸后40分钟 | 加入稀硫酸后50分钟 |
232.4g | 232.3g | 232.2g | 232.1g | 232.1g |
(1)完全反应后生成氢气的质量为______g.
(2)计算该黄铜中铜的质量分数为________(写出计算过程).