题目内容
【题目】下列说法错误的是
A.质量相等的CO2和CO中所含氧原子的个数比是14∶11
B.53g碳酸钠和42g碳酸氢钠分别与过量的盐酸反应,则放出的CO2一样多
C.某化合物3.2g与氧气点燃后恰好完全反应,生成4.4g二氧化碳和3.6g水,该化合物中只含有碳、氢两种元素
D.取一定量氧化铁与氧化铜的混合物,向其中加入50g 14.6%的稀盐酸,恰好完全反应生成盐和水,则原混合物中氧元素的质量是3.2g
【答案】CD
【解析】
A、假设CO2和CO的质量均为m,两种物质的分子个数比为![]() ,则两种物质中所含氧原子的个数比为(7×2)∶11=14∶11,故正确。
,则两种物质中所含氧原子的个数比为(7×2)∶11=14∶11,故正确。
B、根据化学方程式计算可得,53g碳酸钠和过量盐酸反应生成二氧化碳的质量为22g,42g碳酸氢钠与过量盐酸反应生成二氧化碳的质量为22g,则放出的二氧化碳一样多,故正确。
C、根据质量守恒定律可知,反应前后元素的种类和质量不变,则该化合物中碳元素的质量为![]() ,氢元素的质量为
,氢元素的质量为![]() ,1.2g+0.4g=1.6g<3.2g,则该化合物中一定含有氧元素,故错误。
,1.2g+0.4g=1.6g<3.2g,则该化合物中一定含有氧元素,故错误。
D、根据氧化铁和氧化铜与盐酸反应的化学方程式和质量守恒定律可知,氧化物中的氧元素等于生成的水中氧元素的质量,又因为恰好完全反应,可根据盐酸中氯化氢的质量求出生成水的质量。设生成水的质量为x,则
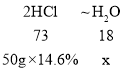
![]()
x=1.8g
所以混合物中氧元素的质量为![]() ,故错误。
,故错误。
故选CD。

练习册系列答案
相关题目
【题目】在一密闭容器内加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,反应前后各物质的质量变化见下表。下列说法中正确的是(_______)
物质 | 甲 | 乙 | 丙 | 丁 |
反应前质量/g | 8 | 32 | 5 | 4 |
反应后质量/g | 16 | 4 | x | 24 |
A 、X=5
B、丙一定为该反应的催化剂
C、反应生成物为乙
D、反应中甲、乙物质的最简质量比为________