题目内容
(7分)金属是我们学习的一类重要物质。
(1)下列金属制品中,利用金属导电性的是 (填字母序号)。

A.不锈钢餐具 B.金箔 C.铜导线
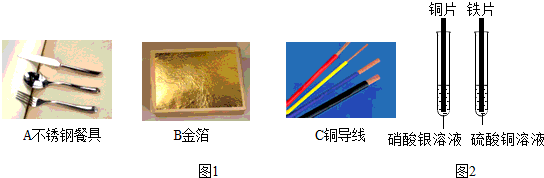
(2)同学们在探究金属的化学性质时,做了如右图所示的两个实验(金属片已打磨)。
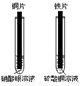
①铁片插入硫酸铜溶液中,铁片表面的现象是 ;
②铜片插入硝酸银溶液中,化学的反应方程式是 。
请结合上述两个实验,推测此实验的目的是 。
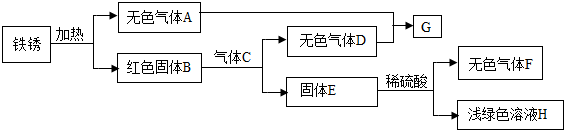
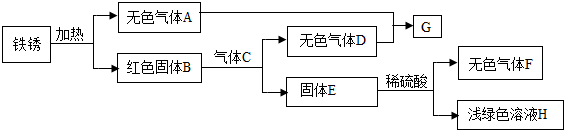
(3)某同学以铁锈为起始反应物,设计实验流程如下(部分反应条件已省略)。
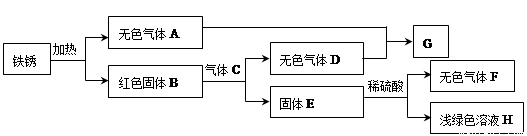
① F的化学式是 ;
② B与C反应的化学方程式是 ;
③ A-H中,能使紫色石蕊溶液变成红色的物质是 (填化学式)。
(1)C
(2)① 有红色物质析出 ② Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
比较铁、铜、银三种金属的活动性
(3)① H2 ② 3CO + Fe2O3 高温 2Fe+3CO2 ③ CO2、H2CO3
【解析】
试题分析:(1)物质的性质决定物质的用途,物质的用途反映物质的性质。
A.不锈钢餐具利用的是其抗腐蚀性好的性质,错误;
B.金箔是利用金属的延展性好而制成的,错误;
C.铜导线利用的是金属的导电性,正确。故选C
(2)①由于铁的活动性比铜强,故铁能置换硫酸铜中的铜,因此,将铁片插入硫酸铜溶液中,铁片表面会有红色物质析出;
②由于铜的活动性比银强,故铜能置换硝酸银中的银,同时生成硝酸铜,故其反应的化学方程式为Cu + 2AgNO3 = Cu(NO3)2 + 2Ag。
结合上述两个实验,可比较得出铁、铜、银三种金属的活动性的强弱,这也是该实验的目的。
(3)铁锈的主要成分是Fe2O3的水合物,可用Fe2O3·xH2O表示,故其加热分解为红色固体Fe2O3(B)和H2O(A);根据图示可知,固体E和稀硫酸反应生成浅绿色溶液H和无色气体F,故可知浅绿色溶液H为FeSO4,则无色气体F为氢气(H2),故固体E为铁;再结合图示:Fe2O3和气体C反应生成Fe和无色气体D,可知是Fe2O3被还原性气体还原生成铁,同时生成气体D,符合题意的C只能是CO,则D是CO2,即3CO + Fe2O3 高温 2Fe+3CO2;再根据A+D→G可知,G为H2CO3。能使紫色石蕊溶液变成红色的物质是酸性物质或能与水反应生成酸的物质,因此,A-H中,CO2和H2CO3能使紫色石蕊溶液变成红色。
考点:金属的物理性质及用途,金属活动性顺序及其应用,物质的鉴别与推断
点评:本题围绕金属考查了多个知识点,其中第3问是难点,在解此类题时,先要找准“题眼”,即有特征的物质或反应现象等,再根据题中的条件进行有目的假设,然后沿着假设进行推导,只要各步都满足,假设就成立,如不满足,可再假设,再验证。

金属是我们学习的一类重要物质。
(1)下列金属制品中,利用金属导电性的是 (填字母序号)。
 |
A.不锈钢餐具 B.金箔 C.铜导线
(2)同学们在探究金属的化学性质时,做了如右图所示的两个实验(金属片已打磨)。
 ①铁片插入硫酸铜溶液中,铁片表面的现象是 ;
①铁片插入硫酸铜溶液中,铁片表面的现象是 ;
②铜片插入硝酸银溶液中,化学的反应方程式是 。
请结合上述两个实验,推测此实验的目的是 。
(3)某同学以铁锈为起始反应物,设计实验流程如下(部分反应条件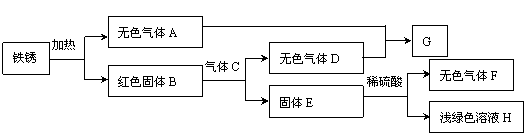 已省略)。
已省略)。
① F的化学式是 ;
② B与C反应的化学方程式是 ;
③ A-H中,能使紫色石蕊溶液变成红色的物质是 (填化学式)。