题目内容
下表是某种常见金属的部分性质:
将该金属投入稀盐酸中,可产生大量的无色气体。根据上述信息回答以下问题:
推断该金属的一种用途__________;
金属的活动性比铜_______. (填“强”或“弱”);
请自选试剂,设计实验探究该金属与铁的活动性强弱.并完成下表.
| 颜色、状态 | 硬度 | 密度 | 熔点 | 导电性 | 导热性 | 延展性 |
| 银白色固体 | 较软 | 2.70g/cm3 | 660.4℃ | 良好 | 良好 | 良好 |
将该金属投入稀盐酸中,可产生大量的无色气体。根据上述信息回答以下问题:
推断该金属的一种用途__________;
金属的活动性比铜_______. (填“强”或“弱”);
请自选试剂,设计实验探究该金属与铁的活动性强弱.并完成下表.
| 你的一种猜想 | |
| 验证方法 | |
| 现象 | |
| 结论 | |
(1)如做导线、做炊具等 (2)强
(3)
(3)
| 你的一种猜想 | 该金属的活动性比铁强 |
| 验证方法 | 分别将该金属和铁加入带稀盐酸中,观察现象 |
| 现象 | 该金属与盐酸反应比铁与盐酸反应更激烈 |
| 结论 | 猜想成立 |
试题分析:(1)性质决定用途,从表中可以看出该金属具有良好的导电、导热、延展性,所以可以推断该金属的一种用途做导线、做炊具等
(2)将该金属投入稀盐酸中,可产生大量的无色气体,而铜不会与盐酸反应,所以金属的活动性比铜强
(3)要验证金属的活动性顺序,可利用的反应原理:1、金属与酸反应(根据是否会与酸反应及发生反应的激烈程度),2、金属与盐溶液反应(根据“强置换弱”的原则来判断金属活动性的强弱),所以;
| 你的一种猜想 | 该金属的活动性比铁强 |
| 验证方法 | 分别将该金属和铁加入带稀盐酸中,观察现象 |
| 现象 | 该金属与盐酸反应比铁与盐酸反应更激烈 |
| 结论 | 猜想成立 |

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案
相关题目

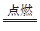 2Fe2O3
2Fe2O3
 2Fe+3CO2
2Fe+3CO2