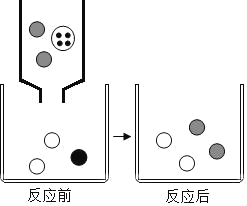
题目内容
碳还原氧化铜的实验如图所示,实验结束时将导管从石灰水中取出后停止加热,冷却至室温。相关分析正确的是( )
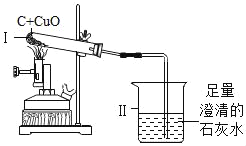
A. 装置II中出现气泡,说明I中反应已开始
B. 反应中,装置I减少的质量是氧元素的质量
C. 冷却后,若装置I中有黑色固体,说明碳有剩余
D. 冷却后,装置I减少的质量小于生成气体的质量
某兴趣小组利用如图装置探究温度对CO还原Fe2O3的影响(固定装置略).

(1)F装置内溶液变浑浊的化学反应方程式为_____;A装置内发生的反应属于_____反应(选填放热或吸热).
(2)装置B的作用是_____.处理尾气的方法为_____.
(3)将该小组分为两组,各取48g氧化铁粉末按如图装置进行对比实验.甲组用酒精灯(火焰温度5000C~7000C)、乙组用酒精喷灯(火焰温度8000C~10000C)分别对装置D充分加热,红色粉末均变为黑色粉末.两组分别用固体产物进行实验,记录如下.
操作步骤 | 甲组现象 | 乙组现象 |
1.称量反应后粉末质量(g) | 44.2 | 33.6 |
2.取黑色粉末用磁铁吸引 | 部分能被磁铁吸引 | 全部能被磁铁吸引 |
3.取黑色粉末加入足量稀盐酸,震荡 | 部分溶解,无气泡 | 全部溶解,有气泡 |
为解释这个现象,小组成员查阅到下列资料:
Ⅰ.已知铁的氧化物有FeO、Fe3O4、Fe2O3,在一定条件下,均能失去或逐步失去其中的氧,最终被还原为铁.
Ⅱ.Fe3O4是一种铁氧体磁性物质,不溶于水和酸.
Ⅲ.氧化铁和一氧化碳进行热反应分析的相关数据图.

(分析与结论)
①乙组的固体产物是_____,产生气泡的化学方程式为_____.
②小军根据实验现象推测甲组的固体产物可能是_____.小华通过计算也证明了小军的观点.试通过计算说明他的推测依据._____
(反思与交流)
考虑到一氧化碳气体通入的不持续性,装置E的作用是_____.从实验安全的角度考虑,上图装置还要采取的改进措施是_____.
垃圾是放错位置的资源.如图是某垃圾处理厂对生活垃圾进行处理的部分工艺流程.请回答下列问题:
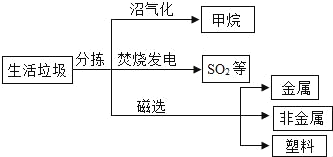
(1)回收塑料可以减少“白色污染”.塑料属于合成材料,下列物质属于合成材料的是_____
A 棉花 B 羊毛 C 蚕丝 D 尼龙
(2)焚烧垃圾发电时产生的二氧化硫污染环境,可以用石灰乳吸收,请用化学方程式表示该原理_____(已知:二氧化硫与石灰乳反应生成CaSO3和水).
(3)沼气化得到的甲烷是一种常用的燃料.
①写出甲烷燃烧的化学方程式_____.
②请完成下列实验报告
操作 | 现象 | 结论 |
点燃甲烷气体,把用澄清石灰水 润湿的烧杯罩在火焰上方 | 烧杯内壁有白色物质出现 | 甲烷中含有_____ |
(4)回收到的非铁金属可用于实验室中学生的探究性实验.
康康选取一定量的含有铜、铝和锌的非铁金属,加入到一定量的AgNO3溶液中,充分反应后过滤.
①若反应后溶液呈蓝色,则向所得固体中滴加稀盐酸_____(填“有”或“没有”)气泡产生.
②若向所得固体中滴加稀盐酸没有气泡产生,则滤液中一定含有哪些溶质_____(写化学式)?
(5)金属铁的回收利用,一定程度可减少“温室气体”的排放.
工业炼铁时会产生大量的二氧化碳,对环境有一定的影响.如果炼出56t铁,则理论上排放二氧化碳多少吨?_____(以赤铁矿为例,其主要成分是氧化铁)


 .该化学式方程式中“
.该化学式方程式中“