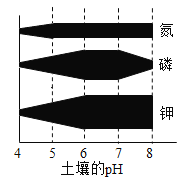
题目内容
【题目】煤是一种化石燃料,某化学小组同学对其组成元素进行了相关探究活动:
(提出问题)煤中是否含有碳元素和硫元素。
(查阅资料)
(1)二氧化硫和二氧化碳一样,也能使澄清石灰水变浑浊,反应的化学方程式为:SO2+Ca(OH)2=CaSO3↓+H2O。
(2)二氧化硫能使高锰酸钾溶液褪色(由紫红色变为无色),该反应的化学方程式为:5SO2+2KMnO4+2X=K2SO4+2MnSO4+2H2SO4,其中X的化学式是__,依据的原理是___。
根据上述资料,甲、乙同学进行了如下实验探究。
(实验探究)
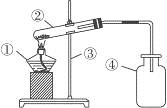
实验1:甲同学进行了如下图所示A、B两步实验:
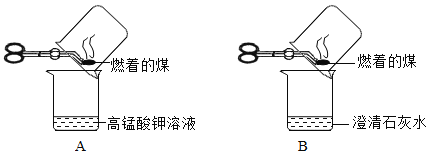
A实验中高锰酸钾溶液褪色,B实验中澄清石灰水变浑浊。甲同学根据A实验中高锰酸钾溶液褪色,得出:煤中含有___元素,根据B实验中澄清石灰水变浑浊得出:煤中含有碳元素。乙同学认为甲同学的方案的不合理,理由是:___。
实验2:乙同学设计并进行了如下图所示实验(夹持装置略去):
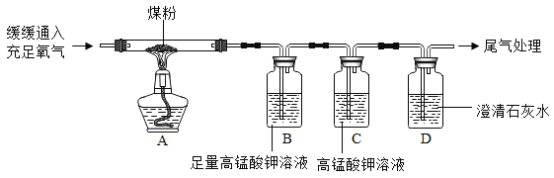
(实验现象)
(1)装置C中的现象是____。
(2)装置D中的现象是___,相应的方程式为:___,该反应在实验室可用来检验___。
(实验结论)煤中含有碳元素和硫元素。
(实验反思)
(1)将煤块粉碎成煤粉的目的是____。
(2)实验中装置C的作用是____。
(3)化石燃料的燃烧会产生大量的二氧化碳,使大气中二氧化碳的含量不断上升,从而导致___效应增强,全球气候变暖。
(拓展运用)
通过该探究活动知道了如何区别二氧化碳和二氧化硫,其方法是____。
【答案】H2O 质量守恒定律(化学变化中,原子的种类、数目不发生改变) 硫(或S) 二氧化硫也会使澄清石灰水变浑浊,无法证明煤中含有碳元素 溶液仍为紫红色 溶液变浑浊 CO2+Ca(OH)2=CaCO3↓+H2O 二氧化碳气体 增大接触面积,使其充分燃烧 检验二氧化硫是否除尽 温室 将气体通入高锰酸钾溶液中,若溶液由由紫红色变为无色,则该气体是二氧化硫,若溶液仍为紫红色,则该气体是二氧化碳。
【解析】
[提出问题]
(2) 据质量守恒定律可知,化学反应前后原子的种类、个数不变,反应前有18个氧原子、2个钾原子、2个锰原子、5个硫原子,反应后有2个钾原子、2个锰原子、5个硫原子,20个氧原子、4个氢原子,所以一个X的分子中有2个氢原子、1个氧原子; X的化学式为H2O:
[实验探究]
实验1:二氧化硫能使高锰酸钾溶液褪色(由紫红色变为无色),二氧化碳能和氢氧化钙反应生成碳酸钙沉淀而使澄清石灰水变浑浊,A实验中高锰酸钾溶液褪色,B实验中澄清石灰水变浑浊。甲同学根据A实验中高锰酸钾溶液褪色,得出:煤中含有硫元素。乙同学认为:甲同学的方案的不合理,理由是:二氧化硫也会使澄清石灰水变浑浊,无法证明煤中含有碳元素;
实验2:
[实验现象]
(1)装置C中的现象是高锰酸钾溶液不褪色,说明二氧化硫已经被吸收尽;
(2)装置D中的现象是澄清石灰水变浑浊,相应的方程式为:CO2+Ca(OH)2=CaCO3↓+H2O,该反应在实验室可用来检验二氧化碳气体;
[实验反思]
(1)将煤块粉碎成煤粉的目的是增大煤和氧气的接触面积,促进煤的燃烧;
(2)实验中装置C的作用是检验二氧化硫是否除尽;
(3)化石燃料的燃烧会产生大量的二氧化碳,使大气中二氧化碳的含量不断上升,从而导致温室效应增强,全球气候变暖;
[拓展运用]
通过该探究活动知道了如何区别二氧化碳和二氧化硫,其方法是体通入高锰酸钾溶液中,若溶液由紫红色变为无色,则该气体是二氧化硫,若溶液仍为紫红色,则该气体是二氧化碳。

【题目】某兴趣小组利用海水(含 NaCl、MgCl2 和 CaCl2 等可溶性杂质及泥沙等难溶性杂质)和石灰石为原料制取漂白粉,流程如下:
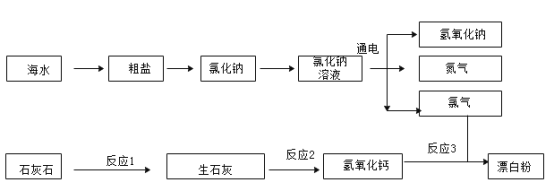
①海水暴晒得到粗盐,利用了氯化钠的溶解度随温度升高而______(选填“变大”、“变小”或“变化不大”)的 性质。
②粗盐提纯得到固体氯化钠,发生了______(填编号)。
A物理变化 B化学变化
③提纯操作中,过滤时用到了铁架台、烧杯、______(填仪器名称)。
④氯化钠溶液通电后发生的不是分解反应,判断的依据是______。
⑤反应1中的化学方程式______。
⑥设计实验方案证明石灰石已完全分解。
实验 | 现象 | 结论 |
______ | ________ | 石灰石已完全分解 |
⑦实际工业生产中,反应3化学方程式:2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2X,X 的化学式为______,Ca(ClO)2中氯元素的化合价为______,反应物氢氧化钙最好用______(填“饱和石灰水”或“石灰乳”)并不断搅拌。
【题目】如表为两种物质在不同温度时的溶解度,请回答
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | KCl | 27.6 | 34.0 | 40.0 | 45.5 | 51.1 | 56.7 |
KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 | |
(1)60℃时,100g 水中最多可溶解_______gKCl 即可达到饱和
(2)40℃时,将 30gKCl加入到 50g 水中,充分溶解后所得溶液是_______ 溶液(填写“饱和”或“不饱和”);
(3)从表中信息可知,在______温度范围内 KNO3 和 KCl 的溶解度相等
(4)将 20℃时 KNO3 和 KCl 的两种饱和溶液升温至 60℃,则两种溶液的溶质质量分数大小关系是:KNO3_________________________KCl(填写“>”、“<”或“=”).