题目内容
铁、铜是我们生活中重要的金属材料.
(1)将油漆涂在铁艺家具上防止生锈,其目的是将铁与空气中的______隔绝.
(2)工业上用一氧化碳和赤铁矿(主要成分是氧化铁)冶炼铁,发生的化学方程式为______.
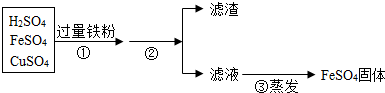
(3)矿物的储量有限,而且不可再生,我们必须保护金属资源并进行金属的回收利用.欲从含有硫酸、硫酸亚铁和硫酸铜的废液中,回收全部铜.处理过程如下:
步骤①加入过量铁粉,发生的反应方程式为:______,______.充分反应后步骤②进行的操作是______,得到的滤渣中含有______,继续处理可以得到纯净的金属铜和硫酸亚铁固体.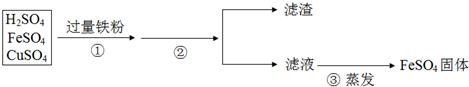
解:(1)涂油漆可使铁不再接触空气中的水和氧气,而不能继续被锈蚀;
(2)一氧化碳高温下与氧化铁反应,生成铁和二氧化碳,化学方程式为3CO+Fe2O3 2Fe+3CO2;
2Fe+3CO2;
(3)根据金属活动性铁>氢>铜,加入的铁粉与硫酸、硫酸铜发生反应,化学方程式为Fe+CuSO4═Cu+FeSO4、Fe+H2SO4═FeSO4+H2↑;充分反应后把固体过滤分离,可得到铁与铜的混合物;
故答案为:
(1)氧气和水;
(2)3CO+Fe2O3 2Fe+3CO2;
2Fe+3CO2;
(3)Fe+CuSO4═Cu+FeSO4;Fe+H2SO4═FeSO4+H2↑;过滤;Fe Cu.
分析:(1)根据对铁生锈的认识,分析涂油漆防止生锈的原理;
(2)根据氧化还原反应发生的规律,写出还原剂一氧化碳还原氧化铁的化学方程式;
(3)根据金属活动顺序表中铁、铜的金属活动性强弱去作答,两种金属的金属活动性由强到弱的顺序为铁>氢>铜.
点评:关于金属铁的相关知识的进行有机组合,可以使零乱的知识形成系统,让学习更有效.
(2)一氧化碳高温下与氧化铁反应,生成铁和二氧化碳,化学方程式为3CO+Fe2O3
 2Fe+3CO2;
2Fe+3CO2;(3)根据金属活动性铁>氢>铜,加入的铁粉与硫酸、硫酸铜发生反应,化学方程式为Fe+CuSO4═Cu+FeSO4、Fe+H2SO4═FeSO4+H2↑;充分反应后把固体过滤分离,可得到铁与铜的混合物;
故答案为:
(1)氧气和水;
(2)3CO+Fe2O3
 2Fe+3CO2;
2Fe+3CO2;(3)Fe+CuSO4═Cu+FeSO4;Fe+H2SO4═FeSO4+H2↑;过滤;Fe Cu.
分析:(1)根据对铁生锈的认识,分析涂油漆防止生锈的原理;
(2)根据氧化还原反应发生的规律,写出还原剂一氧化碳还原氧化铁的化学方程式;
(3)根据金属活动顺序表中铁、铜的金属活动性强弱去作答,两种金属的金属活动性由强到弱的顺序为铁>氢>铜.
点评:关于金属铁的相关知识的进行有机组合,可以使零乱的知识形成系统,让学习更有效.

练习册系列答案
相关题目
学习化学能使我们更好地认识生活中的有关现象,更合理地解决实际问题.
“清明节”小敏一家到福州森林公园进行一趟“化学之旅”,亲身体会到化学就在我们身边.
(1)小敏妈妈为大家准备的食物中有:面包、鸡蛋、苹果、矿泉水等,其中主要为人体提供糖类的食物是________.
(2)旅游途中,小敏把用过的塑料袋和塑料瓶放到路边标有“可回收”字样的垃圾桶中,你认为这样做主要是为了减少________.
(3)登山途中,发现许多“严禁烟火”的标语.小敏联想到城市里禁止燃放孔明灯,原因是孔明灯燃烧时外焰温度高达300℃以上,一旦飘落到加油站、山上、房屋等地,就可能会引发火灾,请你从物质燃烧的条件分析孔明灯在引发火灾所起的作用是________.(填标号)
A.提供可燃物 B.供给氧气 C.使可燃物温度达到着火点
(4)山上长着许多苦笋,苦笋是竹笋的一类,被人们称为笋中珍品.下表列出的是每100g某苦笋含有的部分营养成分:
| 营养成分 | 蛋白质 | 维生素C | 纤维素 | 钙 | 镁 | 磷 |
| 含 量 | 2.6g | 5mg | 1.8g | 9mg | 1mg | 64mg |
②要检验山上的泉水是硬水还是软水,可采用的物质是________(填物质名称).
(5)途中大家还讨论了许多生活中与化学有关的问题,其中有:
①从2010年3月起,福州新增了许多标识有“LNG”的公交车,这些公交车均采用相对清洁的能源--天然气,天然气的主要成分是________(写名称),其完全燃烧的化学方程式是________.
②铁、铜是我们生活中重要的金属材料.铜制品比铁制品耐用、不易生锈,原因是________.铁生锈是铁与________发生复杂的化学反应;防止铁制品生锈的方法________.(答一种)
③2011年3月,日本福岛核电站连续发生爆炸.原因是核电站机组反应堆芯放出氢气,当接触外界的氧气发生剧烈反应导致的.请写出氢气爆炸时的化学方程式________.