题目内容
【题目】科学家用点燃氢气,验证燃烧产物的方法,证实了水的组成.
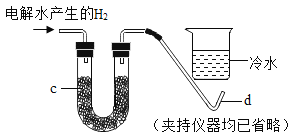
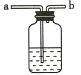
(1)如果将电解水产生的氢气直接缓缓地通过装有足量无水硫酸铜的仪器c,并在导管口b处点燃,然后把盛有冷水的烧杯置于如图所示的位置,实验过程中可以观察到的现象是________.d处发生反应的化学方程式为________
(2)在进行电解水的实验时,常加入少量NaOH以增强水的导电性,NaOH不被电解.若将质量分数为5%的NaOH溶液100g进行电解,当溶液中NaOH的质量分数改变了1%时停止电解,则生成H2的质量约为________ g.
【答案】无水硫酸铜变蓝;导管d处有淡蓝色火焰;烧杯底部附着小水珠 2H2+O2![]() 2H2O 1.9
2H2O 1.9
【解析】
(1)实验过程为用无水硫酸铜检验并除去气体中少量的水,然后点燃气体,氢气燃烧生成的水遇温度较低烧杯,在杯底凝结成液态水;所以观察到的现象是:无水硫酸铜变蓝;导管d处有淡蓝色火焰;烧杯底部附着小水珠;氢气在氧气中燃烧生成水,d处发生反应的化学方程式为2H2+O2![]() 2H2O;
2H2O;
(2)加入少量氢氧化钠是为了增强水的导电性,反应前后其质量保持不变,随着电解水实验的进行,水的质量不断减少,则其溶质的质量分数不断增加,现在溶液中NaOH的质量分数改变了1%,说明变为6%,设现在溶液的质量为X,则有100g×5%=X×6%,解得X≈83.3g,则电解水的质量是100g-83.3g=16.7g,电解水生成氢气和氧气,可知生成H2的质量等于水中氢元素的质量,生成H2的质量=![]() 。
。

练习册系列答案
 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案
相关题目