题目内容
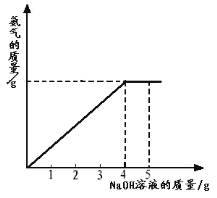
【题目】向盛有 10g49%稀硫酸的烧杯中加入 5.6 克的铁粉,充分反应后有固体残留,t1 时迅速倒入一定量的硫酸铜溶液。整个过程烧杯中溶液的质量随时间的变化如图所示。下列说法正确的是
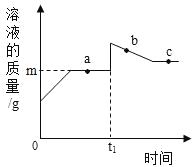
A.取 a 点时的溶液,加入锌粉,无气体放出
B.b 点时,溶液中溶质只有一种
C.c 点时,烧杯中固体一定是铜
D.m=12.7
【答案】AD
【解析】
根据铁与稀硫酸反应的质量比分析剩余的物质是铁,铁与稀硫酸反应溶液的质量增加;t1时迅速倒入一定量的硫酸铜溶液,铁与硫酸铜反应溶液的质量减小进行分析。
由方程式:
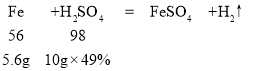
可知,向盛有10g49%稀硫酸的烧杯中加入5.6g克的铁粉,铁粉有剩余,在t1时迅速倒入一定量的硫酸铜溶液,铁与硫酸铜反应溶液的质量减小,因为56份质量的铁能置换出64份质量的铜。
A、由上述分析和图象可知,a点时溶液中没有剩余的稀硫酸,加入锌粉,没有气体放出,故A正确;
B、由图象可知,b点时溶液的质量还在减小,硫酸铜没有完全反应,溶液中溶质有硫酸亚铁和硫酸铜两种,故B错误;
C、由于硫酸铜的量不能确定,可能有剩余的铁,c点时,烧杯中固体一定是有铜,可能有铁,故C错误;
D、设溶液的增量为x

x=2.7g
所以m=10+2.7=12.7,故D正确。
故选:AD。

【题目】沪教版九年级化学下册P197有下列表述:“在金属活动性顺序中,位于氢前面的金属能与酸反应置换出氢气”。
(提出问题)小明同学在阅读课本时提出问题,稀盐酸和浓盐酸反应是否相同?位于氢前面的金属能置换浓硫酸中的氢吗?于是他和同学们一起进行了实验探究。
(实验探究1)小明同学设计了下列实验方案,并记录了实验现象:
实验 | 固体药品 | 液体药品 | 现象 |
① | 铁片5g | 5%的盐酸25mL | 有无色无味的气体产生,反应速度较慢 |
② | 铁片5g | 37%的盐酸25mL | 有无色无味的气体产生,反应速度很快 |
(1)写出实验①中反应生成的盐的化学式是_____。
(2)上述实验设计的思想方法是_____。
(3)经验证实验①和②产生的气体均为H2,由此小明同学得出位于氢前面的金属能置换出稀盐酸和浓盐酸中的氢;由上述实验还能得出的结论是_____。

(实验探究2)甲乙丙丁四位同学分别做了如上四个实验,观察现象,并进行对比。
(1)甲同学观察有气泡产生,写出反应的化学方程式_____。
(2)乙同学的实验现象说明,浓度的改变也会影响物质的_____(填“化学”或“物理”)性质。
(3)丙同学实验时发现产生气泡的速度比甲同学快,说明升高_____能使反应加快。
(4)丁同学实验时闻到有刺激性气味的气体产生。后经查阅资料和实验验证得知该气体是导致酸雨的主要物质,则该气体是_____(写化学式)。该实验说明,锌和浓硫酸在加热时能发生反应,反应类型_____(填“是”或“不是”)置换反应。
(评价反思)在探究酸的化学性质时,教材中的原话强调稀硫酸的原因是_____。
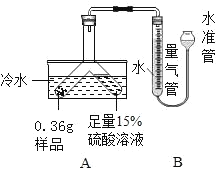
【题目】某化学兴趣小组的同学学习“灭火器原理”后,设计了如下图所示实验,并对反应后瓶中残留废液进行探究。
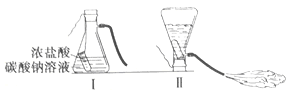
(提出问题)废液中所含溶质是什么?
(猜想与假设)
猜想1:废液中的溶质是NaCl、Na2CO3和HCl
猜想2:废液中的溶质只有NaCl
猜想3:废液中的溶质是NaCl、HCl
猜想4:废液中的溶质是______。
(讨论与交流)
小明认为猜想I无需验证就知道是错误的,他的理由是_____(请用化学方程式说明)。
(实验与结论)
(1)小亮同学为验证猜想3,取少量废液装入试管中,然后滴入酚酞溶液,发现溶液不变色,于是小亮认为猜想3正确。你认为他的结论____(填“正确”或“错误”),理由是______________。
请你另设计实验方案验证猜想3:
实验步骤 | 实验现象 | 实验结论 |
__________________ | __________________ | 猜想3正确 |
(2)验证猜想4,可选择的试剂有____________。
A.酚酞溶液B.氢氧化钾溶液C.稀硫酸D.氯化钡溶液
(拓展与应用)若废液中的溶质是NaCl和HCl,根据盐酸的性质,无需另加试剂,只要对废液进行____操作,即可从废液中得到NaCl固体。