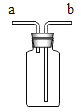
��Ŀ����
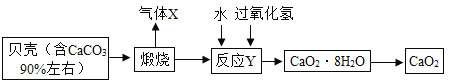
����Ŀ���������ƾ���(CaO28H2O)���ȶ�,�ʰ�ɫ,����ˮ,�㷺Ӧ���ڻ���ɱ����������Ҳ��ʳƷ�����ࡢ��ױƷ���������������Ӽ�,��������Ϊ��������������Ա���Ϊԭ���Ʊ�CaO2����������:
(1)���������ƾ�������Һ����ķ�����_________��
(2)�ҹ��Ƽҵ��������°�����Ϊ����͵��ʹ�ҵ�����ķ�չ�����˽ܳ��Ĺ��ס����Ʊ�ԭ��������X�����������Ʊ���ʳ��ˮ,������Ҫ�����Ƶ�С�մ��ٹ��˲����ȷֽ�С�մ��Ƶô��
��ʵ�������Ӧ�������Ʊ���ʳ��ˮ��ͨ��__________����ԭ����_________��
����д���Ʊ������һ�������Ļ�ѧ��Ӧ����ʽ:________��
(3)��ӦY�����ڽϸ��¶��½��е�ԭ����_________����֪�÷�Ӧ�ǻ��Ϸ�Ӧ,��ӦY�Ļ�ѧ����ʽ��________����õĹ������ƾ����г�����Ca(OH)2����,ԭ����_______��
(4)���������ʵ��ⶨ�ƵõĹ������ƾ���[CaO28H2O]��CaO2����������:��ȡ������Ʒ25g.���ȵ�220��C��ַֽ⣬����ﺬ�в��뷴ӦY�Ĺ������ʺ���ʹ������ľ����ȼ�������(��ʱ�������������������Ϊ1.6g,��֪���ʲ������仯),��þ�.����Ʒ��CaO2������������________��
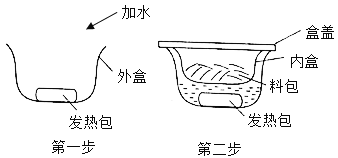
���𰸡����� ���� �������ܽ�ȴ�����̼�ܽ��С����ͨ�백��ʹ����Һ�ʼ��ԣ��������ո���Ķ�����̼���Ӷ��Ƶø���IJ�Ʒ NaCl��CO2��NH3��H2O=NH4Cl��NaHCO3�� ��ֹ�����������ȷֽ� CaO+H2O2+7H2O=CaO28H2O ����������ˮ��Ӧ�����������ƣ���������������ˮ 28.8%
��������
��1�����������Һ����ù��˵ķ������ʹ������ƾ�������Һ����ķ����ǹ��ˣ�
��2���ٰ������ܽ�ȴ�����̼�ܽ��С����ͨ�백��ʹ����Һ�ʼ��ԣ��������ո���Ķ�����̼���Ӷ��Ƶø���IJ�Ʒ��
�ڷ�Ӧ�����Ȼ�����Һ��������������̼��������������̼�����ƾ��壬Ȼ����������غ㶨��д����ѧ��Ӧʽ��ƽ���ɣ�����ʽΪ��NaCl��CO2��NH3��H2O=NH4Cl��NaHCO3����
��3���÷�Ӧ�ķ�Ӧ���������ơ�ˮ�������⣬��Ϊ�����������ȷֽ⣬��Ӧ Y �����ڽϸ��¶��½��У�
�����¶���0��5�棬�����ڱ�ˮ������н��У��÷�Ӧ�ķ�Ӧ���������ơ�ˮ�������⣬��������CaO28H2O����Ӧ�Ļ�ѧ����ʽΪCaO+H2O2+7H2O=CaO28H2O��
��Ϊ����������ˮ��Ӧ�����������ƣ���������������ˮ��
��4������Ʒ��CaO2������Ϊxg������������£�
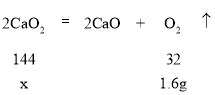
![]() �����x=7.2g��������Ʒ��CaO2����������Ϊ
�����x=7.2g��������Ʒ��CaO2����������Ϊ![]() ��
��

����Ŀ��ѧϰ�˶������̶Թ�������ֽ��д����õ�֪ʶ��С��ͬѧ��:
������ͭ�ܷ������ƶ������̵Ĵ�������?���ǽ���������̽��: .
[����] a ����ͭ���Ǵ�����Ҳ�����뷴Ӧ����Ӧǰ�������ͻ�ѧ���ʲ��䡣
b ����ͭ���뷴Ӧ����Ӧǰ�������ͻ�ѧ���ʷ����˸ı䡣
c ����ͭ�Ƿ�Ӧ�Ĵ�������Ӧǰ��_______________________��
[ʵ��]����ƽ����0.2g����ͭ��ȡ5mI5%�Ĺ���������Һ���Թ��У�ʵ���������:
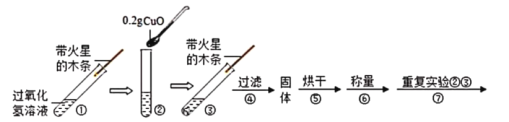
��1����������������ֵ��__________________________________��
��2������ߵ���������Һ���д������ݲ�����������ľ��__________________���ɴ˿ɵó�����:����c������
��3������ٵ�������_____________________��
��������С��ͬѧ̽��Ӱ�췴Ӧ���ʲ������ص����ʵ�����ݡ�
ʵ����� | ����������ҺŨ��/% | ����������Һ���/ml | �¶�/��C | �������̵�����/g | �ռ����������/ml | ��Ӧ�����ʱ��/S |
�� | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
�� | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
�� | 30 | 1 | 35 | 2 | 49.21 | |
�� | 30 | 1 | 55 | 2 | 10.76 |
��4��ͨ��ʵ��ٺ͢ڶԱȿ�֪����ѧ��Ӧ������______________________________�й�;��ʵ��ۺ͢ٶԱȿ�֪����ѧ��Ӧ�������¶ȵĹ�ϵ��________________________________��
[ע��:��������С�⽱��2�֣���ѧ�Ծ��ֲܷ�����40��]
��5��������غ�����ػ�ϼ�����ȡ��������ʼ�������������ʽ�����һ��ʱ����������Լӿ��ԭ����_______________________________��