题目内容
【题目】学习完盐的化学性质以后,同学们做了一个趣味实验,如图所示,甲、乙同学分别在盛有碳酸钠溶液的烧杯中倾倒氯化钡溶液和氢氧化钾溶液,在倾倒过程中观察到烧杯左侧的无色溶液中产生了白色沉淀,倾倒并经过沉降后,他们对最终烧杯内上层清液中所含有的离子展开探究。
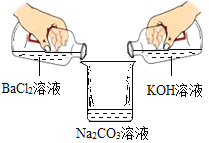
[猜想与假设]甲:Na+、Ba2+、K+、OH-、C1-;
乙:Na+、CO32-、K+、OH-、C1-。
[实验探究]为了验证溶液中的离子成分,甲取上层清液于试管中,向其中加入一定量的Na2CO3溶液,无明显现象。故甲同学的结论:自己猜想错误,乙同学猜想正确。
(1)老师认为甲同学的结论不对,他认为甲的实验只能说明溶液中不含_____(填离子符号,下同),不能说明溶液中含有_____,故只能说明甲同学自己的猜想错误,无法证明乙同学的猜想正确。
(2)乙同学再取上层清液向其中加入足量CaCl2溶液,过滤,向无色滤液中滴加酚酞溶液,观察到_____现象,最终乙同学得出自己的猜想是正确的。
[总结与交流](3)有的同学认为乙同学的实验有的步骤是多余的,你认为删除多余的步骤的理由是_____。
【答案】Ba2+ CO32- 先产生白色沉淀,然后无色溶液变红 实验开始时加入的氢氧化钾不参加反应,一直存在溶液中,使溶液呈碱性
【解析】
{实验探究}(1)碳酸钠溶液中的碳酸钙离子能够与钡离子在溶液中结合生成碳酸钡的白色沉淀,甲取上层清液于试管中,向其中加入一定量的Na2CO3溶液,无明显现象,可以判断原溶液中不含钡离子,其离子符号为Ba2+,故填Ba2+;
甲取上层清液于试管中,向其中加入一定量的Na2CO3溶液,无明显现象,能够判断原溶液中不含钡离子,但并不能判断溶液中碳酸根离子是否存在,无法证明乙同学的猜想正确,故填CO32-;
(2)如果乙同学的猜想是正确的,即溶液中含有Na+、CO32-、K+、OH-、C1-,则向其中加入足量CaCl2溶液后,溶液中Ca2+与CO32-结合生成白色沉淀CaCO3,实验开始时加入的氢氧化钾不参加反应,一直存在溶液中使溶液呈碱性,滴加酚酞溶液后,溶液由无色变成红色,所以实验现象是先生成白色沉淀,后溶液变红,故填先产生白色沉淀,然后无色溶液变红。
{总结与交流}(3)由题意可知,实验开始时加入的氢氧化钾始终不参加反应,一直存在溶液中使溶液呈碱性,所以向无色滤液中滴加酚酞溶液验证溶液是否呈碱性是多余的,可以删去,故填实验开始时加入的氢氧化钾不参加反应,一直存在溶液中,使溶液呈碱性。

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案