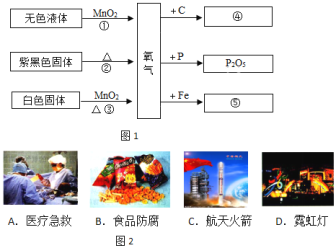
题目内容
【题目】已知A、B、C、D、E是初中化学常见的五种物质,它们之间的转化关系如图所示,部分反应物、生成物及反应条件已略去(图中“→”表示一种物质可以转化为另一种物质)。A、B是组成元素相同的氧化物,C是B、D两物质进行光合作用的产物,E是大理石的主要成分。请回答下列各题:
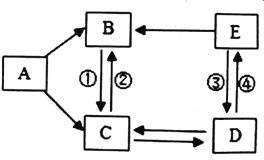
(1)B物质的化学式为_______________;
(2)反应②基本反应类型为__________;
(3)物质C的用途之一为_____________;
(4)反应④的化学方程式为_____________。
【答案】H2O 分解反应 助燃 CO2+Ca(OH)2═CaCO3↓+H2O。
【解析】
E是大理石的主要成分,则E是碳酸钙; C是B、D两物质进行光合作用的产物,光合作用通常是指绿色植物(包括藻类)吸收光能,把二氧化碳(CO2)和水(H2O)合成葡萄糖,同时释放氧的过程。C可能为氧气,B、D为水或二氧化碳, A、B是组成元素相同的氧化物,A能转化为C(氧气),A能转化为B,B与C(氧气)能相互转化,水和过氧化氢都是氢、氧元素组成的氧化物,过氧化氢能转化为氧气,能转化为水,水和氧气能相互转化,则推测A为过氧化氢,B为水,C为氧气,D为二氧化碳,代入检验,符合题意。
(1)根据分析,B物质的化学式为H2O;
(2)反应①为水通电分解生成氢气和氧气,该反应是由一种物质生成两种物质,基本反应类型为分解反应;
(3)根据分析,物质C为氧气,用途之一为助燃;
(4)反应④为二氧化碳与氢氧化钙反应生成碳酸钙和水,化学方程式为CO2+Ca(OH)2═CaCO3↓+H2O。

 阅读快车系列答案
阅读快车系列答案【题目】小军同学准备通过实验证明“二氧化锰能加快氯酸钾分解”。他设计了下表所示的探究实验,请你帮他完成下面未填完的空格
实验操作 | 实验现象 | 实验结论或总结 | ||
结论 | 总结 | |||
实验一 | 加热试管中少量氯酸钾,熔融时,伸入带火星的木条 | 带火星的木条复燃 | 加热氯酸钾能产生氧气,但是反应所需温度_________。 | 二氧化锰能加快氯酸钾分解 |
实验二 | 取少量二氧化锰于试管中,加热,伸入带火星的木条 | 没有明显现象 | ________________ | |
实验三 | _________________, 加热,伸入带火星的木条。 | ______ | 二氧化锰能加快氯酸钾的分解,反应的化学方程式为: ______________。 | |
(1)在小军的探究实验中,“实验一”和“实验二”起的作用是_________。
(2)小英同学认为上面的实验还不能证明二氧化锰是氯酸钾分解反应的催化剂,请你帮她写上理由___。
【题目】镁条在空气中久置表面会变黑。某小组同学设计实验,探究镁条变黑的条件。
(查阅资料)①NaOH浓溶液能与二氧化碳反应,化学方程式为:
2NaOH+CO2=Na2CO3+H2O
②浓硫酸有吸水性,常用做气体的干燥剂
③常温下,亚硫酸钠(Na2SO3)可与O2发生化合反应。
(猜想与假设)常温下,镁条变黑可能与O2、CO2、水蒸气有关。
(进行实验)通过控制与镁条接触的物质,利用下图装置(镁条长度为3 cm,试管容积为20 mL)分别进行下列5个实验,并持续观察20天。

编号 | 主要实验操作 | 实验现象 |
1 | 先充满用NaOH浓溶液洗涤过的空气再加入2mL浓硫酸 | 镁条始终无明显变化 |
2 | 加入2mLNaOH浓溶液 | 镁条始终无明显变化 |
3 | 先加入2mL浓硫酸 再通入约4mLCO2 | 镁条始终无明显变化 |
4 | 先加入4mL饱和Na2SO3溶液 再充满CO2 | 镁条始终无明显变化 |
5 | 先加入2mL蒸馏水 再通入约4mLCO2 | 镁条第3天开始变黑 至第20天全部变黑 |
(解释与结论)
(1)实验1和2中,NaOH浓溶液的作用是____________。
(2)实验1的目的是__________。
(3)实验3中,试管内的气体主要含有CO2、___________。
(4)得出“镁条变黑一定与CO2有关”的结论,依据的两个实验是___________(填编号)。
(5)由上述实验可推知,镁条变黑的条件是__________。
(反思与评价)
(6)在猜想与假设时,同学们认为镁条变黑与N2和稀有气体无关,其理由是__________。
(7)由质量守恒定律推测,镁条变黑后的生成物中一定含有___________元素。