题目内容
【题目】将40g稀盐酸逐滴加入到20g溶质质量分数为4%的氢氧化钠溶液中,边滴加边搅拌.随着稀盐酸的滴加,溶液的pH变化如图一所示,溶液的温度变化如图二所示(不考虑反应过程中热量损失).试回答: 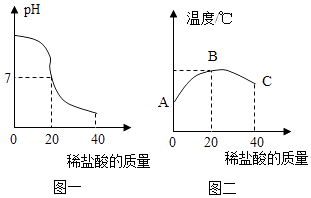
(1)图二从A到B过程中,溶液的pH逐渐(填“增大”或“减小”).
(2)图二表示酸碱恰好完全反应的点是 .
(3)计算稀盐酸中溶质的质量分数.
【答案】
(1)减小
(2)B
(3)解:
由图象可知,恰好酸碱中和时消耗稀盐酸的质量是20g
设20g的稀盐酸中溶质的质量为x
HCl+ | NaOH═NaCl+H2O, |
36.5 | 40 |
x | 20g×4% |
![]() 解得x=0.73g
解得x=0.73g
稀盐酸中溶质的质量分数是: ![]() =3.65%
=3.65%
答:稀盐酸中溶质的质量分数是3.65%
【解析】解:(1)由图象可知,图二从A到B过程中,溶液的pH逐渐减小;(2)中和反应是放热反应,当酸碱恰好完全反应时放出的热量最多,溶液的温度最高,所以图二表示酸碱恰好完全反应的点是B. 答:(1)减小;(2)B;
【考点精析】通过灵活运用根据化学反应方程式的计算,掌握各物质间质量比=系数×相对分子质量之比即可以解答此题.

练习册系列答案
相关题目
【题目】下列一些事实用微观粒子的知识解释错误的是
选项 | 事 实 | 解 释 |
A | 水结冰后体积变大 | 水分子体积变大 |
B | 墙内开花墙外可嗅到花香 | 分子不断运动 |
C | KMnO4和K2SO4溶液的颜色不同 | 两种溶液的阴离子不同 |
D | H2O2 和H2O的化学性质不同 | 两种物质的分子构成不同 |