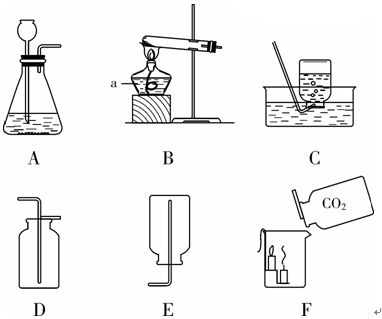
题目内容
(10分)某同学按下图所示装置进行实验,已知过量的C0:通人饱和NaOH溶液中产生白色沉淀(C02+NaOH==NaHC03  )。回答下列问题:
)。回答下列问题:

(1)写出图中标号仪器的名称① 、② 。
(2)写出装置A中反应的化学方程式: 。
(3)通过 (填写操作名称)能把NaHC03晶体从溶液中分离出来。
(4)如果缺少装置B,装置C中会生成的杂质是 。
(5)进行装置D实验时.观察到下层蜡烛比上层蜡烛先熄灭,由此不能得出的实验结论是 (填写字母标号)。
 )。回答下列问题:
)。回答下列问题:
(1)写出图中标号仪器的名称① 、② 。
(2)写出装置A中反应的化学方程式: 。
(3)通过 (填写操作名称)能把NaHC03晶体从溶液中分离出来。
(4)如果缺少装置B,装置C中会生成的杂质是 。
(5)进行装置D实验时.观察到下层蜡烛比上层蜡烛先熄灭,由此不能得出的实验结论是 (填写字母标号)。
| A.二氧化碳不能燃烧 | B.二氧化碳不能支持燃烧 |
| C.二氧化碳的密度比空气的大 | D.二氧化碳能溶于水 |
(1)锥形瓶 导管(各1分,共2分)
(2)CaCO3+2HCl==CaCl2+H20+C02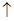 (3)过滤(1分) (4)NaCl
(3)过滤(1分) (4)NaCl
(5)CD(只选C或D得2分,全对得3分)
(2)CaCO3+2HCl==CaCl2+H20+C02
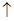 (3)过滤(1分) (4)NaCl
(3)过滤(1分) (4)NaCl(5)CD(只选C或D得2分,全对得3分)
分析:(1)①②均为实验室常用的仪器,熟记常用仪器的名称即可轻松作答.
(2)熟记常用的化学方程式.
(3)从分离固体和液体混合物的方法进行分析.
(4)根据HCl的溶解度随温度升高而降低分析.
(5)具体从两个实验现象进行分析:蜡烛熄灭和下面的蜡烛先灭.
解:(1)熟记常用仪器的名称可知①为锥形瓶;②为导管.
(2)碳酸钙与盐酸反应生成氯化钙、水和二氧化碳.
(3)分离固液混合物的方法是过滤.
(4)碳酸钙和盐酸反应,反应放热,盐酸溶液温度升高,溶解度降低 析出溶质HCl气体 再和NaOH反应生成NaCl,因而C装置中会增加一种物质就是氯化钠.
(5)蜡烛熄灭说明二氧化碳不能燃烧,不能支持燃烧,下面的蜡烛先灭但是由于是从底下供入的二氧化碳,所以不能说明二氧化碳的密度比空气大.
故答案为:(1)锥形瓶;导管
(2)CaCO3+2HCl═CaCl2+H20+C02↑
(3)过滤
(4)NaCl
(5)CD
点评:本道题的难点是第四小题,解题关键是要知道盐酸具有挥发性,能挥发出氯化氢气体,氯化氢气体又极易溶于水,氯化氢气体溶于水后又成为盐酸.
(2)熟记常用的化学方程式.
(3)从分离固体和液体混合物的方法进行分析.
(4)根据HCl的溶解度随温度升高而降低分析.
(5)具体从两个实验现象进行分析:蜡烛熄灭和下面的蜡烛先灭.
解:(1)熟记常用仪器的名称可知①为锥形瓶;②为导管.
(2)碳酸钙与盐酸反应生成氯化钙、水和二氧化碳.
(3)分离固液混合物的方法是过滤.
(4)碳酸钙和盐酸反应,反应放热,盐酸溶液温度升高,溶解度降低 析出溶质HCl气体 再和NaOH反应生成NaCl,因而C装置中会增加一种物质就是氯化钠.
(5)蜡烛熄灭说明二氧化碳不能燃烧,不能支持燃烧,下面的蜡烛先灭但是由于是从底下供入的二氧化碳,所以不能说明二氧化碳的密度比空气大.
故答案为:(1)锥形瓶;导管
(2)CaCO3+2HCl═CaCl2+H20+C02↑
(3)过滤
(4)NaCl
(5)CD
点评:本道题的难点是第四小题,解题关键是要知道盐酸具有挥发性,能挥发出氯化氢气体,氯化氢气体又极易溶于水,氯化氢气体溶于水后又成为盐酸.

练习册系列答案
相关题目