题目内容
【题目】某校学习小组的同学们准备测定某石灰石样品中碳酸钙的质量分数。
(提出问题)如何测定石灰石样品中碳酸钙的质量分数?
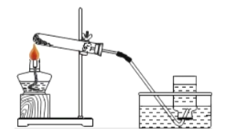
(实验设计)将样品与稀盐酸反应,测定反应后生成 CO2的体积,再根据体积换算为质量,最后根据 CO2的质量求出样品中碳酸钙的质量。下图1为大理石与稀盐酸反应的反应装置,图2用于测量 CO2的体积。
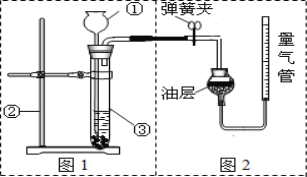
(1)写出图1中仪器的名称:②______________
(2)图1检查装置气密性的方法是:______________。
(3)图2装置中油层的作用是______________。
(4)图1中,长颈漏斗的下端必须伸入液面以下,这样做的目的是__________________,为便于控制反应速率,可用_______________代替长颈漏斗。
(5)___________(填操作方法)可使反应前后油层上方气体压强和外界大气压相同,此时排出水的体积即为生成二氧化碳的体积。
(实验拓展)为进一步探究固体状态与产生气体的关系,同学们进行了如下实验:将采集到的样品用水冲洗后晾干,称取20.00g样品平均分成两份,分别与足量相同质量分数的稀盐酸反应进行下列测定(如图 3),经数据处理得到释放出二氧化碳的质量与反应时间的关系图(如图4)。
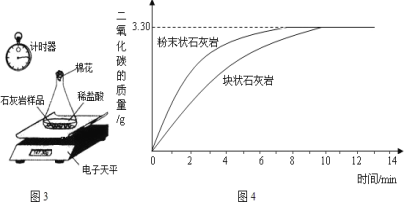
(6)图3所示实验中数据记录纸上应该连续记录的实验数据是计时器读数和____________。
(7)石灰石与稀盐酸反应的化学方程式__________________。
(8)由图 4中曲线可以看出,固体物质与液体物质反应,当其他条件相同时,其影响实验的原因是_____。
(9)试求样品中碳酸钙的质量分数_________(假设样品中其他杂质不参加反应,不考虑水、氯化氢逸出)。
(反思与评价)
(10)有同学认为图3 装置不能准确测定产生的气体的质量,原因是___________。
【答案】铁架台 连接装置,关闭导管止水夹,向长颈漏斗中倒水液封,再加适量水,若形成一段稳定水柱,则装置气密性良好。(注射器检验也可以) 防止CO2溶于水 防止CO2从漏斗口逸散 分液漏斗 调节量气管高度,使反应前后两边液面相平 电子天平示数 CaCO3+2HCl=CaCl2+H2O+CO2↑ 反应物接触面积越大,其反应速率越快(反应物接触面积也可) 75% 气体从锥形瓶口棉花处逸散
【解析】
(1)凡是有气体参加或产生的实验,实验前一定要检查装置的气密性,以防装置漏气影响实验结果;
(2)二氧化碳能够溶于水,不溶于植物油;
(3)碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳;
(4)反应物接触面积越大,反应速率越快;
(5)根据反应的化学方程式和图中提供的数据可以计算样品中碳酸钙的质量分数。
(1)图 1 中仪器的名称是铁架台;
(2)图 1 检查装置气密性的方法是:双手紧握试管,过一段时间,若长颈漏斗在试管中的液面上方形成一段水柱,则证明气密性良好;
(3)二氧化碳能够溶于水,不溶于植物油,图2装置中油层的作用是防止二氧化碳溶于水;
(4)图 1 中,长颈漏斗的下端必须伸入液面以下,这样做的目的是形成液封,为便于控制反应速率,可用分液漏斗代替长颈漏斗;
(5)上下移动量气管,使两边液面相平,可使反应前后油层上方气体压强和外界大气压相同,此时排出水的体积即为生成二氧化碳的体积;
(6)图3所示实验中数据记录纸上应该连续记录的实验数据是计时器读数和电子天平的示数;
(7)碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,反应方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(8)由图4中曲线可以看出,固体物质与液体物质反应,当其他条件相同时,反应物接触面积越大,其反应速率越快;
(9)由图 4 中曲线可以看出二氧化碳的质量为3.30g,设10.00g样品中碳酸钙质量为x,
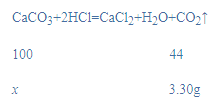
![]()
x=7.5g,
则样品中碳酸钙的质量分数=![]() ×100%=75%;
×100%=75%;
(10)因为图3中的锥形瓶中有空气,而空气中含有二氧化碳气体,所以图3装置不能准确测定产生的气体的质量;故填:锥形瓶中有空气,而空气中含有二氧化碳气体。

 阅读快车系列答案
阅读快车系列答案