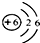题目内容
碳是形成化合物种类最多的元素,含碳物质是中学化学研究的重要内容.
(1)图1为元素周期表中的一格,下列说法正确的是 (填标号).
A.碳元素属于金属元素
B.碳原子核内质子数为6
C.碳元素的原子结构示意图为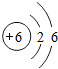
D.碳的相对原子质量为12.01g
(2)活性炭可用于除去有害气体或用于食品工业上的脱色,这是因活性炭有很强 能力.
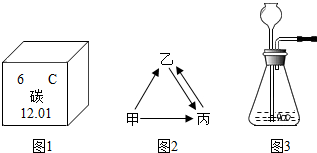
(3)图2中甲、乙、丙三种物质均含有同一种元素,甲是单质,乙、丙是组成元素完全相同的化合物;丙既能够做气肥又能够引起温室效应;它们之间有如图2所示的转化关系(部分物质和反应条件已经略去).
则:丙发生化合反应生成乙的化学方程式为 ;从微观的角度解释乙、丙性质有差异的原因是 .
(4)实验室确定气体发生装置时应考虑的因素是 ;写出用图3装置制取氧气的化学方程 ;
检查该装置的气密性的方法是:将该装置中导气管上的胶皮管用弹簧夹夹住,往长颈漏斗中注入水至液面高出漏斗颈的下端管口后,继续注水,若能观察到 现象,即可证明装置不漏气.
(5)称取12.5g石灰石(主要成分是CaCO3,杂质不参加反应)放入烧杯中,向其中加入足量稀盐酸,完全反应后发现质量减少4.4g (气体的溶解忽略不计).试计算石灰石中CaCO3质量.

(1)图1为元素周期表中的一格,下列说法正确的是
A.碳元素属于金属元素
B.碳原子核内质子数为6
C.碳元素的原子结构示意图为
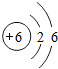
D.碳的相对原子质量为12.01g
(2)活性炭可用于除去有害气体或用于食品工业上的脱色,这是因活性炭有很强
(3)图2中甲、乙、丙三种物质均含有同一种元素,甲是单质,乙、丙是组成元素完全相同的化合物;丙既能够做气肥又能够引起温室效应;它们之间有如图2所示的转化关系(部分物质和反应条件已经略去).
则:丙发生化合反应生成乙的化学方程式为
(4)实验室确定气体发生装置时应考虑的因素是
检查该装置的气密性的方法是:将该装置中导气管上的胶皮管用弹簧夹夹住,往长颈漏斗中注入水至液面高出漏斗颈的下端管口后,继续注水,若能观察到
(5)称取12.5g石灰石(主要成分是CaCO3,杂质不参加反应)放入烧杯中,向其中加入足量稀盐酸,完全反应后发现质量减少4.4g (气体的溶解忽略不计).试计算石灰石中CaCO3质量.
分析:(1)根据元素周期表中的一个小格中的信息可知元素的名称、元素符号、质子数、相对原子质量等来解答即可.
(2)根据活性炭的吸附性进行分析.
(3)根据物质的组成特点及变化关系,推断三种物质,并完成对与所推断物质的问题分析.
(4)本题考查的是氧气的制取装置,同时也考查了选择发生装置时应考虑的因素,制取装置包括加热和不需加热两种,要根据具体药品的状态和反应的条件决定.
(5)根据质量守恒定律,反应前后减少的质量为二氧化碳的质量,利用碳酸钙与盐酸反应的化学方程式,根据二氧化碳的质量可求出碳酸钙的质量.
(2)根据活性炭的吸附性进行分析.
(3)根据物质的组成特点及变化关系,推断三种物质,并完成对与所推断物质的问题分析.
(4)本题考查的是氧气的制取装置,同时也考查了选择发生装置时应考虑的因素,制取装置包括加热和不需加热两种,要根据具体药品的状态和反应的条件决定.
(5)根据质量守恒定律,反应前后减少的质量为二氧化碳的质量,利用碳酸钙与盐酸反应的化学方程式,根据二氧化碳的质量可求出碳酸钙的质量.
解答:解:(1)A、因碳的偏旁为“石”,则碳元素为非金属元素,故A说法错误;
B、由信息可知,碳原子的质子数为6,故B说法正确;
C、碳原子的质子数为6,则原子结构中最外层电子数应为4,故C说法错误;
D、由信息可知,碳原子的相对原子质量为12.01,故D说法错误;
(2)活性炭可用于除去有害气体或用于食品工业上的脱色,这是因活性炭有很强吸附能力;
(3)丙既能够做气肥又能够引起温室效应,因此丙是二氧化碳;乙、丙是组成元素完全相同的化合物,因此乙是一氧化碳,甲是单质,应为氧气,碳具有还原性,在高温下能将二氧化碳还原成一氧化碳;
根据物质结构决定性质,二氧化碳与一氧化碳的组成元素相同,但两物质的分子结构不同,所以两物质的性质有差异;
(4)发生装置时应考虑的因素是:反应物的状态和反应条件;图3装置属于固液在常温下制取氧气,应用过氧化氢溶液和二氧化锰混合制取氧气;检查该装置的气密性的方法是:将该装置中导气管上的胶皮管用弹簧夹夹住,往长颈漏斗中注入水至液面高出漏斗颈的下端管口后,继续注水,若能观察到液面不再下降现象,即可证明装置不漏气;
(5)设石灰石中CaCO3的质量为X,则
CaCO3+2HCl═CaCl2+CO2↑+H2O
100 44
X 4.4g
=
,解得X=10g
故答案为:(1)B;(2)吸附;(3)CO2+C
2CO;两种物质的分子构成不同;(4)反应物的状态和反应条件等;2H2O2
2H2O+O2↑;液面不再下降;(5)石灰石中CaCO3质量为10g.
B、由信息可知,碳原子的质子数为6,故B说法正确;
C、碳原子的质子数为6,则原子结构中最外层电子数应为4,故C说法错误;
D、由信息可知,碳原子的相对原子质量为12.01,故D说法错误;
(2)活性炭可用于除去有害气体或用于食品工业上的脱色,这是因活性炭有很强吸附能力;
(3)丙既能够做气肥又能够引起温室效应,因此丙是二氧化碳;乙、丙是组成元素完全相同的化合物,因此乙是一氧化碳,甲是单质,应为氧气,碳具有还原性,在高温下能将二氧化碳还原成一氧化碳;
根据物质结构决定性质,二氧化碳与一氧化碳的组成元素相同,但两物质的分子结构不同,所以两物质的性质有差异;
(4)发生装置时应考虑的因素是:反应物的状态和反应条件;图3装置属于固液在常温下制取氧气,应用过氧化氢溶液和二氧化锰混合制取氧气;检查该装置的气密性的方法是:将该装置中导气管上的胶皮管用弹簧夹夹住,往长颈漏斗中注入水至液面高出漏斗颈的下端管口后,继续注水,若能观察到液面不再下降现象,即可证明装置不漏气;
(5)设石灰石中CaCO3的质量为X,则
CaCO3+2HCl═CaCl2+CO2↑+H2O
100 44
X 4.4g
| 100 |
| 44 |
| X |
| 4.4g |
故答案为:(1)B;(2)吸附;(3)CO2+C
| ||
| ||
点评:根据化学方程式进行计算时,只能使用纯净物的质量进行计算,而不能把混合物的质量直接代入化学方程式进行计算,质量守恒定律在计算中的运用是化学计算的一个常见内容,一般的规律是依据质量的变化求出某一生成的质量,再结合反应方程式分析解答.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
 碳是形成化合物种类最多的元素,含碳物质是中学化学研究的重要内容.
碳是形成化合物种类最多的元素,含碳物质是中学化学研究的重要内容. 碳是形成化合物种类最多的元素,含碳物质是中学化学研究的重要内容.
碳是形成化合物种类最多的元素,含碳物质是中学化学研究的重要内容.
 碳是形成化合物种类最多的元素,含碳物质是中学化学研究的重要内容.
碳是形成化合物种类最多的元素,含碳物质是中学化学研究的重要内容. D.碳的相对原子质量为12.01
D.碳的相对原子质量为12.01
 碳是形成化合物种类最多的元素,含碳物质是中学化学研究的重要内容.
碳是形成化合物种类最多的元素,含碳物质是中学化学研究的重要内容.