题目内容
【题目】某兴趣小组的同学在甲、乙两个充满O2的密闭容器中各加入一定量的碳粉,在高温条件下使其充分反应,待反应结束后,两个容器中的碳粉都已完全消失。该小组成员对两容器中反应后的气体进行如下探究:
(1)小红同学对甲容器中气体的组成提出如下四种猜想:
A.只有CO2 B.只有O2
C.只有CO D.CO和O2混合气体
你认为上述猜想中明显不合理的有 (填序号)。
(2)小明同学认为甲容器中的气体还可能是CO和CO2的混合气体,为了验证自己的猜想,他准备按下图所示装置进行探究。
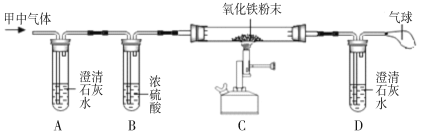
请回答:
①装置B中浓硫酸的作用是 。
②若小明的猜想成立,则装置A中的实验现象是 ,反应的化学方程式是 ,装置C玻璃管中的实验现象是 ,反应的化学方程式是 。
(3)小芳同学对乙容器中气体的组成提出了除上述猜想外的另一种合理猜想,她的猜想是 ,于是她设计了下列实验方案验证其猜想:
【步骤l】先加热装有铜丝网的玻璃管一段时间后,再通入乙中的气体,观察现象。
【步骤2】将乙中的气体通入澄清石灰水中,观察现象。
指导老师在分析其实验方案后,指出了其中存在的错误或不足。
①步骤1应先通入乙中气体一段时间后方可加热。你认为这样修改的原因是 。
②没有必要进行步骤2的实验,其理由是 。
【答案】(1)BD
(2)①干燥气体 ②澄清石灰水变浑浊 CO2 +Ca(OH)2==CaCO3↓+ H2O
红色粉末变成黑色 Fe2O3+3CO高温 2Fe+3CO2
(3)CO2和O2 的混合气体
①排净玻璃管中的空气,排除空气中氧气的干扰
②碳在氧气充足的情况下燃烧产物为二氧化碳
【解析】
试题分析:(1)碳会与氧气反应,故反应后的容器中不可能只含有氧气或是一氧化碳和氧气的混合物,故选BD;
(2)二氧化碳能使澄清的石灰水变浑浊,一氧化碳具有还原性,能还原氧化铁生成铁和二氧化碳。故A装置中的澄清石灰水是检验混合气体中是否含有二氧化碳;B装置中的浓硫酸起干燥作用;C和D装置是检验一氧化碳的存在,若有一氧化碳,C中的红色粉末会变成黑色,D装置中的澄清石灰水会变浑浊;
(3)若氧气过量的,混合气体还可能是二氧化碳和氧气的混合物;该同学的设想是:先加热装有铜丝网的玻璃管一段时间后,再通入乙中的气体,若含有氧气,氧气会与铜反应生成铜,现象是红色的固体会变成黑色;再将乙中的气体通入澄清石灰水中,若含有二氧化碳,那么澄清的石灰水会变浑浊;但由于空气中含有氧气,会对氧气的检验造成干扰,故加入铜之前要把玻璃管中的氧气除去;由于碳完全燃烧生成的二氧化碳,故没有必要检验二氧化碳的存在。

【题目】(9分)张华同学对酸、碱、盐的知识进行了以下的梳理。
(1)填写下表空格中的化学式。
氯化钾 | 氯化钙 | 氯化钠 | 氯化镁 | 氯化铝 | 氯化锌 | 氯化亚铁 | 氯化铜 |
KCl | CaCl2 | NaCl | MgCl2 | ZnCl2 | FeCl2 |
思考:根据以上盐中的金属元素的排列,可以得出他是依据______________顺序归纳整理的。
(2)为理解稀盐酸和氢氧化钠两者之间发生反应的微观实质,绘制了如图。请你在右边的圆圈中填入适当的化学式或离子符号:

(3)张华同学发现酸、碱、盐之间的反应都有盐类物质生成。请写出一个能生成MgCl2的复分解反应的化学方程式:__________________________。
(4)我们知道溶液酸碱度pH可显示的溶液的酸碱性;酸溶液pH<7,溶液显酸性;碱溶液pH>7,溶液显碱性.提出问题:盐溶液的pH怎样呢?盐溶液显什么性呢?
猜想与假设:盐溶液的pH可能为:pH=7、pH<7、pH>7.
设计与实验:下列是两同学分别对相同的NaCl溶液、CuSO4溶液、K2CO3溶液的pH进行的测定实验:甲同学:取pH试纸放在玻片上,用玻棒蘸取测试液滴在pH试纸上,试纸显色后与pH标准比色卡比较.乙同学:取pH试纸放在玻片上,用蒸馏水将pH试纸润湿,再用玻棒蘸取测试液滴在pH试纸上,试纸显色后与pH标准比色卡比较.
记录数据:下表是两同学记录所测pH的实验数据:
NaCl溶液 | CuSO4溶液 | K2CO3溶液 | |
甲同学 | 7 | 4 | 10 |
乙同学 | 7 | 5 | 9 |
结论:通过测定几种盐溶液的pH,可以得出的结论是: .
评价与反思:上述两同学测得的数据,反映了溶液真实pH的是 同学。