题目内容
已知某固体粉末是由NaCl、Ba(NO3)2、CuSO4、Na2SO4、Na2CO3中的一种或几种组成,取这种粉末加足量的水,振荡后呈浑浊,再加稀盐酸,沉淀不溶解,过滤后得无色滤液,取滤液并滴加AgNO3溶液产生白色沉淀,对原固体粉末的判断正确的是( )
| A.可能含CuSO4和Na2CO3 |
| B.一定含NaCl,可能含Ba(NO3)2、Na2SO4,一定不含Na2CO3、CuSO4 |
| C.一定含NaCl、Ba(NO3)2、Na2SO4,一定不含Na2CO3,可能含CuSO4 |
| D.可能含NaCl,一定含Ba(NO3)2、Na2SO4,一定不含Na2CO3、CuSO4 |
由于混合物加水震荡后有浑浊,说明生成沉淀,但是没有提到颜色,说明混合物中没有带颜色的离子,可得无硫酸铜.沉淀可能是硫酸钡或者是碳酸钡,或者两者都有,即原混合物一定含有硝酸钡.沉淀中加入稀盐酸,沉淀不溶解,说明该沉淀是硫酸钡,而非碳酸钡或者是不含碳酸钡.因此可以下结论原混合物含有硫酸钠,而不含碳酸钠.过滤后加入硝酸银,本意是检测原混合物中是否含有氯化钠,但是由于中间过程加入了稀盐酸,导致无法下结论.
因此通过实验可知,原混合物一定含有硝酸钡和硫酸钠,一定不含硫酸铜和碳酸钠,可能含有氯化钠(或者说氯化钠不能确定)
故选:D.
因此通过实验可知,原混合物一定含有硝酸钡和硫酸钠,一定不含硫酸铜和碳酸钠,可能含有氯化钠(或者说氯化钠不能确定)
故选:D.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 金属是现代生活和工业生产中应用极为普遍的一类材料.
金属是现代生活和工业生产中应用极为普遍的一类材料.(1)已知在相同的条件下,金属的活动性越强,金属和酸反应产生气泡(氢气)的速度就越快.Al、Cu、Fe三种金属在稀盐酸里的反应现象如右图所示.
①右图中Y所代表的金属是
②Al、Cu、Fe三种金属的活动性由强到弱的顺序为
③铝是一种活泼金属,但常温下铝却有较强的抗腐蚀性,其原因是
(2)金属的开发和利用是人类文明和社会进步的标志.
①我国古代将炉甘石(ZnCO3)、赤铜矿(Cu2O)和木炭粉混合加热至800℃左右,即可得到与黄金外观相似的“药金”.
I.用上述方法不能制得真正的黄金(Au)是因为
II.“药金”是
②钛因常温下不与酸、碱反应等优良的性能,被誉为“未来金属”.由钒钛磁铁矿提取金属钛的主要工艺过程如下:
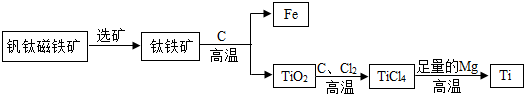
在高温下与足量Mg反应置换生成金属Ti,该反应的化学方程式为:
上述生产过程中得到的金属钛中混有少量金属杂质,可加入
(3)已知某金属粉末中除含有Al外还含有一定量的Fe和Cu,为证明Fe和Cu的存在并测定其中Al的质量分数,某化学兴趣小组的同学展开了如下的实验探究.
资料在线:Al与氢氧化钠溶液反应生成溶于水的偏铝酸钠和氢气(反应的化学方程式为:2Al+2H2O+2NaOH=2NaAlO2+3H2↑),Fe和Cu不与氢氧化钠溶液反应.
①请完成证明金属粉末中存在Fe和Cu的实验设计:
| 实验操作 | 实验现象 | 结论 |
| Ⅰ取少量的金属粉末于试管中,加入足量的 |
仅除去铝 | |
| Ⅱ将试管静置,弃去上层清液,加入足量的稀硫酸. | 证明含有铁 | |
| Ⅲ将试管静置,弃去上层清液,多次洗涤剩余固体 | 剩余固体呈紫红色 | 证明含有铜 |
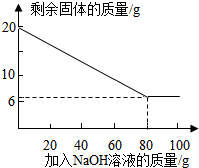 ②为探究该金属粉末中Al的质量分数,取20 g该金属粉末,把100 g氢氧化钠溶液平均分成5份依次加入,充分反应后,过滤出固体,将其洗涤、干燥、称量.实验过程中得到的部分数据与图象如下:
②为探究该金属粉末中Al的质量分数,取20 g该金属粉末,把100 g氢氧化钠溶液平均分成5份依次加入,充分反应后,过滤出固体,将其洗涤、干燥、称量.实验过程中得到的部分数据与图象如下:| 加NaOH溶液的次数 | 第一次 | 第二次 | 第三次 | … |
| 剩余固体的质量/g | 16.5 | n | 9.5 | … |
Ⅱ.该金属粉末中Al的质量分数为
Ⅲ.列式计算:所用氢氧化钠溶液的溶质质量分数为多少?
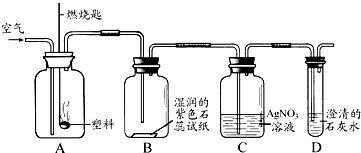
 O2
O2  2nCO2+nH2O+nHCl
2nCO2+nH2O+nHCl





 O2
O2  2nCO2+nH2O+nHCl
2nCO2+nH2O+nHCl