题目内容
【题目】如图是A、B、C三种物质的溶解度曲线,回答下列问题。
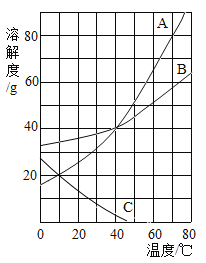
(1)40℃时,溶解20gA物质,至少需要_________g水。
(2)30℃时,用等质量的三种物质配成饱和溶液,所需水的质量的大小关系是______________。
(3)能将A、B、C三种物质的不饱和溶液都变为饱和溶液的方法是______________。
(4)10℃时,将三种物质的饱和溶液各100g分别加热蒸发10g水后,再恢复到10℃,剩余溶液的质量由大到小的顺序是_______________,此时A溶液的溶质质量分数是_________________(精确至0.1%)
(5)探究比较A和B在水中的溶解性,必须控制的相同条件是______________。
A水的质量
B固体的颗粒大小
C温度
D搅拌速率
(6)我国北方有许多盐碱湖,湖水中溶有大量的氯化钠和纯碱,那里的农民¨冬天捞碱,夏天晒盐”,请解释其原理____________。
【答案】50 B<A<C(或C>A> B) 加入溶质(或蒸发溶剂) A=C>B 16.7% C 纯碱的溶解度随温度升高而增大且受温度影响较大,冬天温度较低,溶解在水中的碳酸钠会结晶析出,氯化钠溶解度受温度影响很小,夏天温度高时水分蒸发,氯化钠析出(合理即可)
【解析】
(1)40℃时,A物质的溶解度为40g,则在该温度下溶解20gA物质,至少需要水的质量为50g。
(2)30℃时,A、B、C三种物质的溶解度大小关系为B>A>C,则用等质量的三种物质配成饱和溶液,所需水的质量的大小关系是B<A<C。
(3)A物质和B物质的溶解度随温度的升高而升高,C物质的溶解度随温度的升高而降低。将A物质和B物质的不饱和溶液变为饱和溶液的方法有加入溶质、蒸发溶剂、降低温度;将C物质的不饱和溶液变为饱和溶液的方法有加入溶质、蒸发溶剂、升高温度;因此将A、B、C三种物质的不饱和溶液都变为饱和溶液共同的方法是加入溶质或蒸发溶剂。
(4)10℃时三种物质溶解度关系为B>A=C,10℃时,将三种物质的饱和溶液各100g,分别加热蒸发10g水后,再恢复到10℃,B析出固体质量最多,A和C析出固体质量相同,所以剩余溶液的质量由大到小的顺序是A=C>B,此时A溶液仍为该温度下的饱和溶液,A溶液的溶质质量分数是![]() 。
。
(5)影响物质溶解性的因素有溶质的性质、溶剂的性质、温度,而溶质颗粒的大小和搅拌速率只会影响溶解速率的快慢。所以探究比较A和B在水中的溶解性,可以比较相同温度下等量水中溶解A、B质量的大小,也可以比较相同温度下等量的A、B全部溶解至少需要水的质量的大小,因此必须控制的相同条件是温度。故选C。
(6)“冬天捞碱”是因为纯碱的溶解度随温度升高而增大且受温度影响较大,冬天温度降低,溶解在水中的碳酸钠会结晶析出;“夏天晒盐”是因为氯化钠溶解度受温度影响很小,夏天温度高时水分蒸发,氯化钠析出。

 名校课堂系列答案
名校课堂系列答案