题目内容
【题目】有一包固体,可能由硝酸铜、硫酸钠、氯化钠、碳酸氢钠、氢氧化钠中的一种或几种组成。为了探究该固体的组成,某化学小组设计并开展以下实验:已知,步骤Ⅰ中固体全部消失,溶液呈蓝色,无气泡产生,步骤Ⅱ、Ⅲ中均可观察到有白色沉淀生成。则下列说法正确的是 ( )
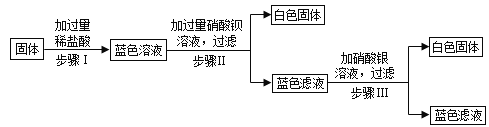
A.氯化钠一定是原固体中含有的物质
B.原固体中一定不含氢氧化钠、碳酸氢钠
C.步骤Ⅱ所得蓝色滤液中一定含有的溶质是4种
D.原固体中一定含有的物质是硝酸铜、硫酸钠、氯化钠
【答案】C
【解析】
步骤Ⅰ中固体全部消失,溶液呈蓝色,无气泡产生,说明固体中含硝酸铜,铜离子显蓝色,碳酸氢钠能与稀盐酸反应生成氯化钠、二氧化碳和水,无气泡产生,说明不含碳酸氢钠,步骤Ⅱ、Ⅲ中均可观察到有白色沉淀生成,硝酸钡能与硫酸钠反应生成硫酸钡沉淀,说明固体中含硫酸钠,由于步骤Ⅰ中加入过量盐酸,盐酸能与硝酸银反应生成氯化银沉淀,故不能确定固体中是否含氢氧化钠、氯化钠。
A、由分析可知,固体中可能含有氯化钠,不符合题意;
B、由分析可知,固体中可能含氢氧化钠,一定不含碳酸氢钠,不符合题意;
C、向固体中加过量稀盐酸,得到蓝色溶液,蓝色滤液中溶质一定含有硝酸铜,加过量硝酸钡,硝酸钡与硫酸钠反应生成硫酸钡和硝酸钠,蓝色滤液中溶质一定含有硝酸钠,由于稀盐酸和硝酸钡过量,故步骤Ⅱ所得蓝色滤液中一定含有的溶质是4种,符合题意;
D、由分析可知,原固体中一定含有的物质是硝酸铜、硫酸钠、可能含有氯化钠,不符合题意。
故选C。

 名校课堂系列答案
名校课堂系列答案【题目】为探究盐酸的化学性质,某化学小组做了如下实验:

(1)上述反应中无现象的为_______(填字母序号,下同),有白色沉淀出现的是_______;B试管中所发生反应的化学方程式为_______________________________。
(2)将反应后D和E试管中的废液倒入一个洁净的烧杯中,观察到烧杯中先有气泡产生,后有白色沉淀出现。将烧杯中的混合物过滤,得到白色沉淀和无色滤液。同学们对滤液中溶质的成分进行
探究。
(提出问题)滤液中溶质的成分是什么?
(假设与猜想)猜想一:NaCl 猜想二:NaCl和CaCl2
猜想三:NaCl、Ca(OH)2和HCl 猜想四:_____
(讨论与交流)经讨论,同学们一致认为猜想________是错误的。
(实验与结论)
实验步骤 | 实验现象 | 实验结论 |
取少量滤液于试管中,滴加适量碳酸钠溶液 | 无现象 | 猜想四成立 |
取少量滤液于试管中,滴加适量____ | _______ |
(拓展与迁移)稀盐酸和稀硫酸有相似的化学性质,是因为它们的溶液中都存在__________。
【题目】化学研究性学习小组对铁生锈开展深入的探究。
(1)比较与分析铁钉在不同条件下生锈程度。同学们设计了如图所示的对比实验,并进行实验。4h后观察到:试管Ⅰ、Ⅱ中的铁钉均生锈,试管1铁钉生锈程度大于试管Ⅱ;试管Ⅲ中铁钉不生锈。

①试管Ⅰ铁钉生锈程度大于试管Ⅱ的原因是________ 。
②试管Ⅲ中,使用冷却后的沸水的目的是________ 。
③铁钉生锈的其中一步反应是铁与氧气、水共同作用生成氢氧化亚铁,该反应的化学方程式是________。
(2)探究植物油能否完全隔绝氧气。
同学们第二天观察,发现试管Ⅲ中的铁钉也有些锈斑。为此大家又做了如下探究。
[进行实验]实验1:将涂水的铁片置于植物油中,并放置于密封的无氧容器中,8h后观察铁片无锈迹。排除植物油和铁片上的水中微量氧气对铁片锈蚀的影响。
实验2:将涂水的铁片置于植物油中,并敞口放置于空气中,8h后发现少量锈斑,再过一段时间后观察,锈斑面积增大。
①综合以上两个实验,可得出的结论是________ 。
[交流讨论]②查阅文献获知,植物油对空气中的水分有较好的隔绝效果,请设计实验方案加以验证:________。
(3)在老师的指导下,进一步探究酸性条件下铁锈蚀的情况。
[查阅资料]
Ⅰ.溶解氧是指溶解在水里氧气的量,用每升水里氧气的毫克数表示。
Ⅱ.醋酸具有酸的通性,能与活泼金属发生反应。
[实验探究]
将4份等质量的铁粉和碳粉的混合物分别加入相同体积不同pH的醋酸的水溶液中,分别用溶解氧传感器和压强传感器采集数据获得下图和下表。
[Failed to download image : http://192.168.0.10:8086/QBM/2019/7/3/2238641521827840/2239037686308864/STEM/7adc329db9cd448f8855f4be1c1bba3a.png]
pH | 压强/KPa | ||
实验前 | 实验后 | 压强差 | |
2.0 | 90.56 | 91.58 | 1.02 |
3.0 | 90.46 | 91.23 | 0.77 |
4.0 | 90.48 | 90.34 | -0.14 |
5.0 | 90.81 | 90.64 | -0.17 |
①从左上图中可知,在酸性条件下水溶液中溶解氧随时间变化均呈下降趋势,原因是________。
②从右上表中可知pH为2.0~3.0时,实验后系统中气体压强增大,是因为________。




