题目内容
【题目】实验室常用甲酸(H2CO2)和浓硫酸混合加热制备一氧化碳,反应方程式为H2CO2![]() H2O+CO↑,再用一氧化碳还原氧化铜,反应方程式为CO+CuO
H2O+CO↑,再用一氧化碳还原氧化铜,反应方程式为CO+CuO![]() Cu+CO2,实验装置如图所示。请回答:
Cu+CO2,实验装置如图所示。请回答:
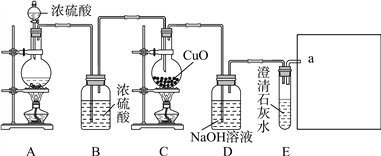

(1)装置G中①的名称是_______,装置B的作用是____________。
(2)装置E是用来检验装置D吸收二氧化碳是否完全,该装置______(填“能”或“不能”)达到目的;写出D中发生反应的化学方程式:____________________________。
(3)为避免一氧化碳污染空气,回收利用一氧化碳,方框中应连接装置F和G,导管接口的顺序为a→____→_____→e。
(4)反应过程中,装置C的烧瓶内氧化铜粉末处于“沸腾”状态(一氧化碳气流冲击所致),这样有利于________________________________,烧瓶内固体物质的颜色变化:_____________________。
(5)请你设计一个探究氧化铜是否反应完全的实验:__________________________________。
【答案】 烧杯 干燥CO气体 不能 CO2+2NaOH===Na2CO3+H2O d b CO与CuO充分接触,使CuO充分反应 由黑色变成红色 取反应后的固体物质于试管中,加入足量的稀盐酸,振荡观察溶液颜色
【解析】(1)装置G中①是烧杯;浓硫酸具有吸水性,可以除去一氧化碳中的水蒸气;(2)用澄清的石灰水来检验二氧化碳是否除净,需要将气体通入石灰水中,即进气管应伸入液面以下,所以图示装置不能达到目的;二氧化碳与氢氧化钠反应生成碳酸钠和水,反应的化学方程式:2NaOH+CO2=Na2CO3+H2O;(3)为避免将CO排放到空气中,并回收利用CO,即用C装置来收集二氧化碳,一氧化碳难溶于水,长导管是出水管,则导管接口的连接顺序应为a→d→b→e;(4)装置C的烧瓶内氧化铜粉末处于“沸腾”状态,这样增大了氧化铜粉末与一氧化碳气体的接触面积,反应更充分;在加热的条件下,一氧化碳能将黑色的氧化铜还原为红色的铜; (5)氧化铜能与酸反应得到蓝色溶液,而铜与酸不反应,所以可设计如下实验:取少量的固体样品于试管中,加入适量的稀盐酸,振荡观察溶液的颜色。

 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案